Introducción
El carcinoma testicular de células germinales no seminomatoso (NSGCT) es una patología potencialmente curable en estadios IA o IB, sin embargo existe un riesgo de enfermedad micrometastásica al retroperitoneo del 28-30%1,2. Sin evidencia sedimentada en superioridad entre las diferentes alternativas, el tratamiento adyuvante ha demostrado reducir la tasa de recurrencia al 2-8%3. Las opciones de tratamiento adyuvante son: la vigilancia activa (VA), la quimioterapia (QT) adyuvante y la linfadenectomía retroperitoneal (LRP) clasificatoria4. Los criterios utilizados actualmente para guiar esta terapia se relacionan hasta con un 50-70% de sobretratamiento en caso de optar por QT o cirugía, sometiendo a los pacientes a efectos adversos innecesarios.
No hay estudios en Colombia que evalúen la supervivencia en pacientes sometidos a diferentes tratamientos adyuvantes posterior a orquiectomía; adicionalmente se desconoce el impacto en pronóstico de los criterios de riesgo para recaída descritos en la literatura en este país. Este estudio tiene como fin analizar la diferencia en supervivencia global (SG) y supervivencia libre de recurrencia (SLR) en estos pacientes manejados con vigilancia, LRP primaria o QT adyuvante. Adicionalmente, busca determinar cuáles son los factores asociados a mortalidad o recurrencia de la enfermedad en cada una de las líneas de tratamiento. Este conocimiento pretende ser de utilidad para la toma de decisiones basada en la evidencia en la práctica del urólogo y el urólogo oncólogo.
Métodos
Se trata de un estudio analítico de cohorte retrospectiva, de carácter observacional. Se realizó una revisión de las historias clínicas de pacientes con NSGCT estadio I llevados a orquiectomía radical entre el 1 de enero de 1990 y el 28 de febrero 2022. Se obtuvieron a partir del sistema SAP con el código Clasificación Internacional de Enfermedades (CIE) 10 para tumor maligno del testículo (C62.9) 772 pacientes, de los cuales se incluyeron para análisis el 17,3% de los pacientes (134 pacientes) (Fig. 1).

Figura 1. Pacientes incluidos para revisión de historia clínica.
Como criterios de inclusión se tuvieron en cuenta pacientes con diagnóstico de NSGCT estadio IA o B (fecha de orquiectomía radical), registro en historia clínica de radiografía de tórax o tomografía axial computarizada (TAC) de tórax, TAC de abdomen y pelvis contrastado y marcadores tumorales negativos postoperatorios (S0) para compromiso metastásico. Se excluyeron los pacientes con ausencia de datos sobre la estadificación inicial y aquellos que recibieron tratamiento adyuvante no estándar (radioterapia retroperitoneal adyuvante).
Se construyó una base de datos con las variables SG y SLR utilizando el registro de la historia clínica institucional y los datos de afiliación al sistema general de salud en la plataforma Administradora de los Recursos del Sistema General de Seguridad Social en Salud (ADRES). Se muestran curvas de Kaplan-Meier para el global de la población y para cada uno de los subgrupos de tratamiento. Adicionalmente, utilizando el software R se estimaron por medio de análisis univariante de las diferencias entre hazard ratios (HR) crudos de la SG y SLR de cada grupo.
Las variables demográficas extraídas a partir de los ítems registrados en la base de datos se describieron con medidas de tendencia central (Tabla 1). Se registraron datos en términos de edad, antecedentes, comportamiento de marcadores testiculares, subtipo histológico, clasificación pT y tratamiento primario, entre otros. Por medio del software R se estableció la homogeneidad entre estas características en los diferentes grupos de tratamiento, identificando así posibles variables de confusión.
Tabla 1. Características demográficas
| Criterio | VA (45 pt) | LRP (39 pt) | QT adyuvante (13 pt) | p |
|---|---|---|---|---|
| Edad (años) mediana, rango | 23,6 (15,5-41,6) | 27,1 (19,5-68,9) | 19,7 (15,8-35,1) | 0,138 |
| Diámetro mayor (cm) mediana, rango | 5 (1-8) | 5 (1,5-10) | 6,5 (2-9,1) | 0,266 |
| Estadio pT, n (%) | ||||
| pT1 | 39 (90,7) | 27 (73) | 10 (76,9) | 0,197 |
| pT2 | 4 (9,3) | 10 (27) | 3 (23,1) | |
| Estadio, n(%) | ||||
| Estadio IA | 37 (86) | 21 (56,8) | 10 (76,9) | 0,027 |
| Estadio IB | 6 (14) | 16 (43,2) | 3 (23,1) | |
| Alfafetoproteína pre quirúrgica, n(%) | ||||
| Elevadas | 20 (69) | 20 (58,8) | 7 (70) | 0,702 |
| β-HCG prequirúrgica, n (%) | ||||
| Elevadas | 13 (50) | 14 (42,4) | 5 (45,5) | 0,681 |
| LDH prequirúrgica, n (%) | ||||
| Elevadas | 4 (19) | 9 (33,3) | 0 (0) | 0,243 |
| Subtipo histológico n |
||||
| Carcinoma embrionario | 13 | 22 | 11 | 0,86 |
| Teratoma | 13 | 20 | 8 | 0,611 |
| Seno endodérmico | 13 | 16 | 6 | 0,73 |
| Seminoma | 9 | 11 | 5 | 0,277 |
| Coriocarcinoma | 2 | 0 | 1 | 0,41 |
| > 50% CE presente, n (%) |
12 (40) | 12 (40) | 6 (20) | 0,571 |
| LVI presente, n (%) |
5 (22,7) | 14 (63,6) | 3 (13,6) | 0,209 |
| Presencia de GCNIS, n (%) |
10 (29,4) | 16 (47) | 7 (20,5) | 0,861 |
|
* Se alcanzó significancia estadística (p < 0,05). † Número de pacientes con reporte de algún porcentaje de la variante. ‡ Se tomaron datos reportados en patología INC. β-HCG: gonadotrofina coriónica humana; INC: Instituto Nacional de Cancerología; LDH: lactato deshidrogenasa; LRP: linfadenectomía retroperitoneal; LVI: invasión linfobascular; QT: quimioterapia; VA: vigilancia activa; CE: carcinoma embrionario; GCNIS: neoplasia in situ de células germinales. |
||||
Las estimaciones de los parámetros se realizaron con un nivel de confianza del 95%, y las pruebas de hipótesis con nivel de significancia del 5%. Todos los análisis estadísticos se realizan con el software estadístico R 4.1.2 y su interfaz gráfica RStudio 2021.09.0+351.
Se definió SG como la media de tiempo desde el inicio del seguimiento (fecha de la orquiectomía) hasta la muerte. Se extrajeron los datos sobre supervivencia a partir de la historia clínica del Instituto Nacional de Cancerología (INC) o del registro nacional sobre vinculación al sistema de salud (ADRES). Los pacientes que no se encontraron incluidos fueron excluidos para análisis de supervivencia.
La recurrencia retroperitoneal fue definida como la aparición de lesiones retroperitoneales documentadas en TAC o resonancia (RM) de abdomen posterior a una estadificación y tratamiento inicial como estadio I. El tiempo a la recurrencia retroperitoneal se interpretó como el tiempo desde la fecha de inicio de seguimiento (fecha de orquiectomía radical) hasta la fecha en que se documentó la lesión retroperitoneal (fecha de la TAC o la RM positiva).
La recurrencia sistémica se entendió como la aparición de lesiones metastásicas a distancia como pulmón, ganglionar no retroperitoneal y hepáticas, entre otras, en el seguimiento de pacientes estadificados y manejados inicialmente como un estadio I. El tiempo a la recurrencia sistémica se interpretó como el tiempo desde la fecha de la orquiectomía radical hasta la fecha en que se documentó la enfermedad metastásica (fecha de TAC, radiografía o RM).
El tiempo de SLR fue el tiempo medio de seguimiento (desde la orquiectomía radical) estimado libre de documentación de recurrencia o muerte.
Resultados
De 772 pacientes con NSGCT, se identificaron 134 pacientes (17,3%) con estadio I, de estos 111 pacientes (82,8%) cumplieron criterios de inclusión. Cuarenta y cinco pacientes (40,5%) fueron manejados con VA, 39 (35,1%) con linfadenectomía retroperitoneal clasificatoria, 13 (11,7%) con QT adyuvante y en 14 pacientes (12,6%) no había datos sobre el tratamiento adyuvante administrado.
Para un tiempo de seguimiento medio de 3,9 años (rango: 0-19,8 años; intervalo intercuartílico [IQR]: 0,8-5,7 años), el porcentaje de pacientes libres de recurrencia a 5 y 10 años fue del 73,3%. En el análisis clasificado por grupo de tratamiento (grupo 1, VA; grupo 2, LRP, y grupo 3, QT) no se encontró diferencia estadística en el HR para recaída (p = 0,25) (Fig. 2).
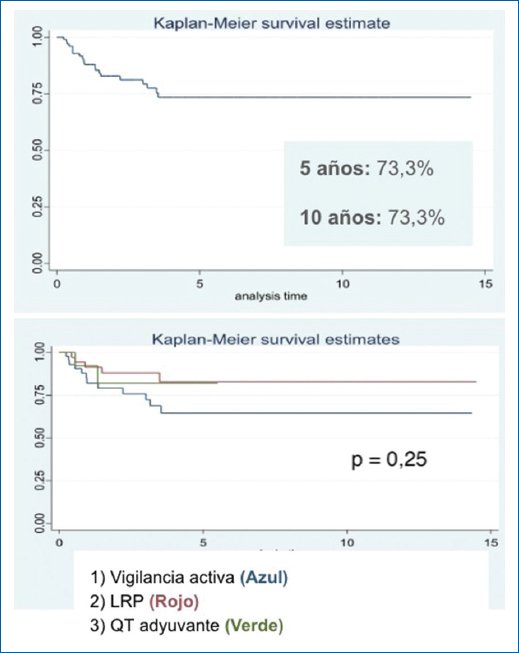
Figura 2. Curvas de Kaplan-Meier sobre supervivencia libre de recurrencia.
Se realizó un análisis por regresión de Cox para evaluar la relación entre factores pronóstico y el desenlace de recurrencia, tal como se describe en la tabla 2.
Tabla 2. Relación entre factores pronóstico y desenlace de recurrencia
| Variable | HR | IC95% | p |
|---|---|---|---|
| LVI presente | 4,68 | 1,24-17,68 | 0,014 |
| % teratoma | 2,00 | 0,41-9,74 | 0,39 |
| % CE ≥ 70% | 1,88 | 0,66-5,37 | 0,24 |
| % CE ≥ 50% | 1,85 | 0,64-5,36 | 0,24 |
| Diámetro ≥ 6 cm | 1,6 | 0,46-5,6 | 0,45 |
| > pT1 | 1,54 | 0,55-4,29 | 0,42 |
| % teratoma ≥ 50 | 1,5 | 0,43-5,16 | 0,52 |
| LDH elevada pre-Qx | 1,50 | 0,38-5,90 | 0,56 |
| % CE | 1,37 | 0,29-6,45 | 0,68 |
| β-HCG elevada pre-Qx | 1.07 | 0,35-3.21 | 0,90 |
| Edad (años) | 0,99 | 0,99-0,99 | 0,062 |
| AFP elevada pre-Qx | 0,99 | 0,33-2,97 | 0,99 |
| Diámetro mayor (cm) | 0,914 | 0,69-1,20 | 0,51 |
| Estadio Ib | 0,82 | 0,29-2,30 | 0,71 |
| % seno endodérmico | 0,60 | 0,07-5,17 | 0,63 |
| Tratamiento adyuvante | |||
| VA | Ref | Ref | 0,25 |
| LRP | 0,44 | 0,15-1,25 | |
| QT adyuvante | 0,53 | 0,11-2,38 | |
| % Seminoma | 0,19 | 0,00-4,88 | 0,23 |
| Compromiso de rete testis | ND | ND | 0,47 |
| GCNIS | ND | ND | 0,07 |
|
AFP: alfafetoproteína; β-HCG: gonadotrofina coriónica humana; HR: hazard ratio; IC95%: intervalo de confianza del 95%; LDH: lactatodeshidrogenasa; LRP: linfadenectomía retroperitoneal; LVI: invasión linfobascular; ND: no disponible; QT: quimioterapia; Qx: cirugía; VA: vigilancia activa; CE: carcinoma embrionario; GCNIS: neoplasia in situ de células germinales. |
|||
Con un tiempo de seguimiento hasta de 19 años y un seguimiento medio de 3,9 años, se determinó una SG a los cinco años del 93% y a los 10 años del 83,7%. En el análisis clasificado por grupo de tratamiento (grupos 1 [VA], 2 [LRP] y 3 [QT]) no se encontró diferencia estadísticamente significativa en el HR para mortalidad (p = 0,61) (Fig. 3).
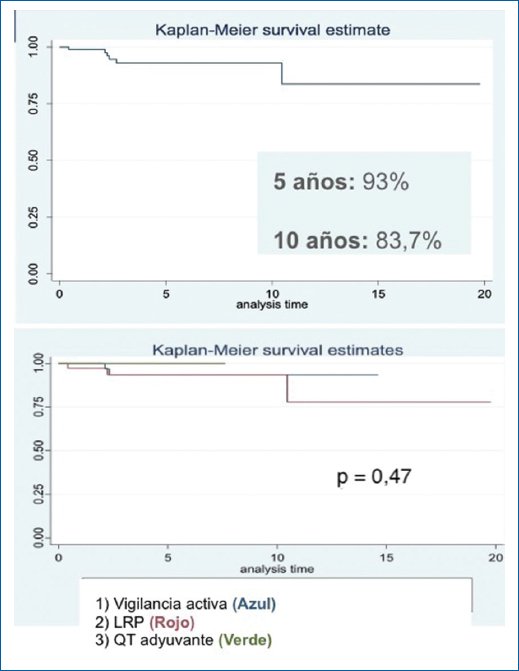
Figura 3. Curvas de Kaplan-Meier sobre supervivencia global.
Se realizó un análisis por regresión de Cox para evaluar la relación entre factores pronóstico y el desenlace de recurrencia, tal como se describe en la tabla 3.
Tabla 3. Relación entre factores pronóstico y desenlace de recurrencia
| Variable | HR | IC95% | p |
|---|---|---|---|
| % teratoma | 41,5 | 1,32-1305 | 0,01 |
| % teratoma ≥ 50 | 7,75 | 0,8-74,84 | 0,051 |
| > pT1 | 4,13 | 0,82-20,58 | 0,09 |
| Estadio Ib | 2,28 | 0,45-11,4 | 0,31 |
| % CE > 50% | 2,02 | 0,23-17,68 | 0,49 |
| Diámetro mayor (cm) | 1,46 | 0,93-2,29 | 0,1 |
| β-HCG elevada pre-Qx | 1,97 | 0,32-11,96 | 0,45 |
| Tratamiento adyuvante | |||
| VA | Ref | Ref | Ref |
| LRP | 1,60 | 0,26-9,70 | 0,47 |
| QT adyuvante | NC | NC | NC |
| LVI presente | 1,15 | 0,15-8,68 | 0,88 |
| Edad (años) | 1,00 | 0,93-1,08 | 0,65 |
| AFP elevada pre-Qx | 0,98 | 0,15-6,02 | 0,98 |
| % CE > 70% | 0,50 | 0,054-4,64 | 0,51 |
| % Seno endodérmico | 0,46 | 0,00-27,18 | 0,69 |
|
AFP: alfafetoproteína; β-HCG: gonadotrofina coriónica humana; HR: hazard ratio; IC95%: intervalo de confianza del 95%; LRP: linfadenectomía retroperitoneal; LVI: invasión linfobascular; NC: no calculable; QT: quimioterapia; Qx: cirugía; VA: vigilancia activa; CE: carcinoma embrionario; GCNIS: neoplasia in situ de células germinales. |
|||
Discusión
Nuestra población demostró mayor derivación a VA, fue más frecuente la LRP que la QT adyuvante. La QT adyuvante fue el tratamiento menos utilizado (11,7%), diferente a lo registrado en otras series como la de Castellanos et al., donde el 32% recibieron esta terapia5. La media de seguimiento de este estudio fue de 3,9 años, identificando una tasa de SG a 5 y 10 años del 94,2 y el 93,7% respectivamente. Estos resultados son similares a los de Sturgeon et al., con un tiempo medio de seguimiento de 6,3 años y una tasa de SG del 98,9%6. Al igual que en estudio de Winner et al., no se encontraron diferencias en SG en los diferentes grupos de tratamiento adyuvante7. En la regresión logística se documentó la presencia de teratoma como factor de riesgo para mortalidad con un HR de 41. La presencia de este como variable asociada a mortalidad tiene resultados inconsistentes en la literatura. En un estudio retrospectivo de Alexandre et al. con 88 pacientes, encontraron un menor riesgo de mortalidad en pacientes con presencia de teratoma en la patología de la orquiectomía con un riesgo relativo (RR) de 0,2 (intervalo de confianza del 95% [IC95%]: 0,1-0,6)8.
En cuanto a SLR con el mismo tiempo de seguimiento, se documentó una tasa libre de recurrencia a los 5 y 10 años del 73,3%, sin diferencia entre los subgrupos de tratamientos adyuvantes. La tasa de SLR tiene una tendencia a ser inferior a otros estudios, como el de Fan et al., con un tiempo de seguimiento de 5,5 años y una tasa libre de recurrencia del 89,9%9. En el estudio anterior no se documentó diferencia entre LRP y VA, lo que concuerda con nuestros resultados. Por otro lado, no se reprodujeron los resultados del estudio de Albers et al. ni Tandstad et al., donde se encontró superioridad de la QT adyuvante sobre la LRP y QT adyuvante sobre VA respectivamente1,3. En cuanto a la regresión logística, se encontró únicamente asociación con la presencia de invasión linfovascular (LVI) y mayor riesgo de recurrencia, con un HR 4,6. Estos resultados son consistentes con los resultados de Kollmannsberger et al., donde la LVI se estableció como el principal predictor de recurrencia en una serie de pacientes en VA10. Por otro lado, factores asociados a SLR documentados por Scandura et al., como el tamaño tumoral, el porcentaje de CE y la invasión de la rete testis, no se reprodujeron en nuestro estudio11.
Conclusiones
Este es el primer estudio en América del Sur realizado en un centro de referencia de manejo en cáncer que evalúa las diferentes líneas de adyuvancia en NSGCT estadio I posterior a orquiectomía radical. La SG en estos pacientes continúa siendo cercana al 100% independientemente del tratamiento adyuvante que se ofrezca, resaltando la necesidad de realizar adyuvancia basada en riesgo para evitar el sobretratamiento y efectos adversos asociados. No se encontraron diferencias en SG ni SLR entre VA, LRP o QT adyuvante. Este estudio resalta la importancia de la LVI con respecto a un mayor riesgo de recurrencia y la presencia de teratoma para riesgo de mortalidad. Son necesarios estudios prospectivos, aleatorizados, multicéntricos y con tiempos de seguimiento superiores a 10 años con el fin de aumentar las herramientas para orientar al urólogo en la elección de la mejor terapia adyuvante para cada caso.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido la aprobación del Comité de Ética para el análisis y publicación de datos clínicos obtenidos de forma rutinaria. El consentimiento informado de los pacientes no fue requerido por tratarse de un estudio observacional retrospectivo.
Uso de inteligencia artificial para generar textos. Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.
