Introducción
El cáncer renal (CR) es uno de los tumores más frecuentes en el mundo; en 2020 según GLOBOCAN se estimaron cerca de 431.288 casos incidentes y 179.368 muertes secundarias a CR1. La mayoría de los casos en la actualidad se detectan de forma incidental en estadios tempranos, corresponden a CR de células claras y son susceptibles de tratamiento con intención curativa mediante cirugía (nefrectomía radical, nefrectomía parcial o tumorectomía) o terapias ablativas. Sin embargo, entre el 20 y 40% de estos tumores a pesar de recibir tratamiento con intención curativa pueden presentar recaída locorregional o progresar a estados metastásicos de la enfermedad2.
Para la enfermedad metastásica con diagnóstico de novo el estándar de manejo actual incluye la modulación del microambiente tumoral mediante la administración de fármacos inhibidores de puntos de control (checkpoints) inmunológicos o inhibidores de la tirosina cinasa que impiden el crecimiento desmedido de las células tumorales mediante la modulación de la expresión de factores que favorecen la angiogénesis; los resultados clínicos en este escenario han sido favorables en términos de supervivencia general y calidad de vida de los pacientes3, por lo que la terapia sistémica, como se conoce a este de tipo de intervención, hace parte junto a la nefrectomía citorreductora (en escenarios seleccionados) del pilar de tratamiento en este grupo de pacientes4.
Para la enfermedad localizada el estándar de manejo actual es el tratamiento con intención curativa mediante cirugía o terapias ablativas y la posterior observación clínica. Los resultados con la terapia estándar han sido consistentemente favorables; el advenimiento de técnicas quirúrgicas de mínima invasión ha permitido ofrecer un tratamiento quirúrgico efectivo con pérdida mínima de tejido renal funcional para los pacientes con masas renales pequeñas localizadas, sin embargo, una proporción importante de pacientes pueden presentar progresión de su enfermedad o recaídas tumorales tras el tratamiento primario. En este escenario clínico no se ha logrado definir aún cuál es el impacto real de la adyuvancia con inmunoterapia o con inhibidores de la tirosina cinasa. Los datos clínicos son contradictorios y no han permitido aún que ninguna de las principales guías urológicas de práctica clínica postule como recomendación fuerte su uso de forma sistemática en el paciente con tumor renal localizado tras el tratamiento primario.
A la fecha se han identificado factores clínicos que predicen el riesgo de progresión de la enfermedad tumoral renal, entre los que se encuentran: la edad del paciente, el tipo histológico tumoral, el tamaño tumoral, el compromiso ganglionar regional [N+], el grado histológico tumoral y el estado funcional del paciente. Y se han desarrollado algunas escalas clínicas que ayudan a estimar el riesgo de progresión de la enfermedad oncológica o recaída en el corto y mediano plazo5, pero se desconoce si el uso de terapias adyuvantes es realmente capaz de modificar los desenlaces clínicos/oncológicos de interés en este tipo de pacientes6,7 o si estas estrategias podrían generar efectos consistentemente positivos en los desenlaces clínicos y oncológicos de interés en esta población.
Por tal razón el objetivo de esta scoping review es definir a la luz de la evidencia actual la eficacia clínica (entendida en desenlaces como: supervivencia general, supervivencia específica de cáncer, supervivencia libre de recaída tumoral, supervivencia libre de progresión tumoral) de la terapia adyuvante con inmunoterapia o inhibidores de la tirosina cinasa en pacientes adultos con CR localizado comparada con la eficacia de la terapia estándar de manejo, definida como el tratamiento basado en intervención quirúrgica con intención curativa y la posterior observación.
Método
Esta scoping review se ejecutó y reportó de acuerdo con las directrices PRISMA ScR (Preferred Reporting Items for Systematic Reviews and Meta-Analyses extension for scoping reviews), desarrollando la pregunta PICO:
- – P = pacientes > 18 años con CR de células claras localizado tratados con terapia estándar.
- – I: terapia adyuvante con inhibidores puntos de control (checkpoints) inmunológicos o inhibidores de tirosina cinasa.
- – C: terapia estándar (nefrectomía o nefrectomía parcial).
- – O: supervivencia libre de progresión, supervivencia libre de enfermedad, efectos adversos.
Para identificar los posibles documentos de interés se ejecutó una búsqueda sistemática en las bases de datos electrónicas de Medline y Embase utilizando combinaciones de operadores booleanos (AND, OR) y los términos MesH y Emtree: “renal cell carcinoma”, “adult”, “middle aged”, “nephrectomy”, “partial nephrectomy”, “adjuvant therapy”, “immune checkpoint inhibitor” y “protein tyrosine kinase inhibitor”.
Se limitó la búsqueda a estudios clínicos aleatorizados ejecutados en humanos adultos (> 18 años). La búsqueda no tuvo restricciones de idioma ni de tiempo. Todos los resúmenes fueron revisados por dos autores, se excluyeron registros duplicados, estudios en contexto de enfermedad metastásica de alta carga/irresecable o con histología diferente a tumor renal de células claras. Se ejecutó además una búsqueda secundaria por estrategia «bola de nieve». La última actualización de la búsqueda se ejecutó en mayo de 2024.
Adicionalmente se ejecutó una búsqueda en Lilacs utilizando combinaciones de los términos Decs: “carcinoma de células renales”, “inmunoterapia”, “sunitinib” y “proteínas tirosina quinasas”, sin obtener registros (estudios clínicos aleatorizados) adicionales para inclusión en el análisis.
La evaluación del riesgo de sesgos se llevó a cabo utilizando la herramienta RoB28,9, disponible en el material suplementario.
Resultados
Se identificaron 34 referencias; los títulos y resúmenes fueron evaluados por dos de los autores. Se aplicaron los criterios de exclusión (se describen en la figura 1) y finalmente se seleccionaron 12 estudios clínicos aleatorizados. Ocho de ellos se obtuvieron tras la ejecución de la búsqueda sistemática y cinco estudios adicionales se incluyeron tras búsqueda de información en estrategia de bola de nieve. Un artículo identificado por la estrategia de bola de nieve se excluyó por ser un subanálisis de un estudio registrado (duplicidad de resultados) que no mencionaba datos relacionados con la pregunta PICO establecida10. En total se incluyeron para análisis 12 estudios (Fig. 1)11–22.
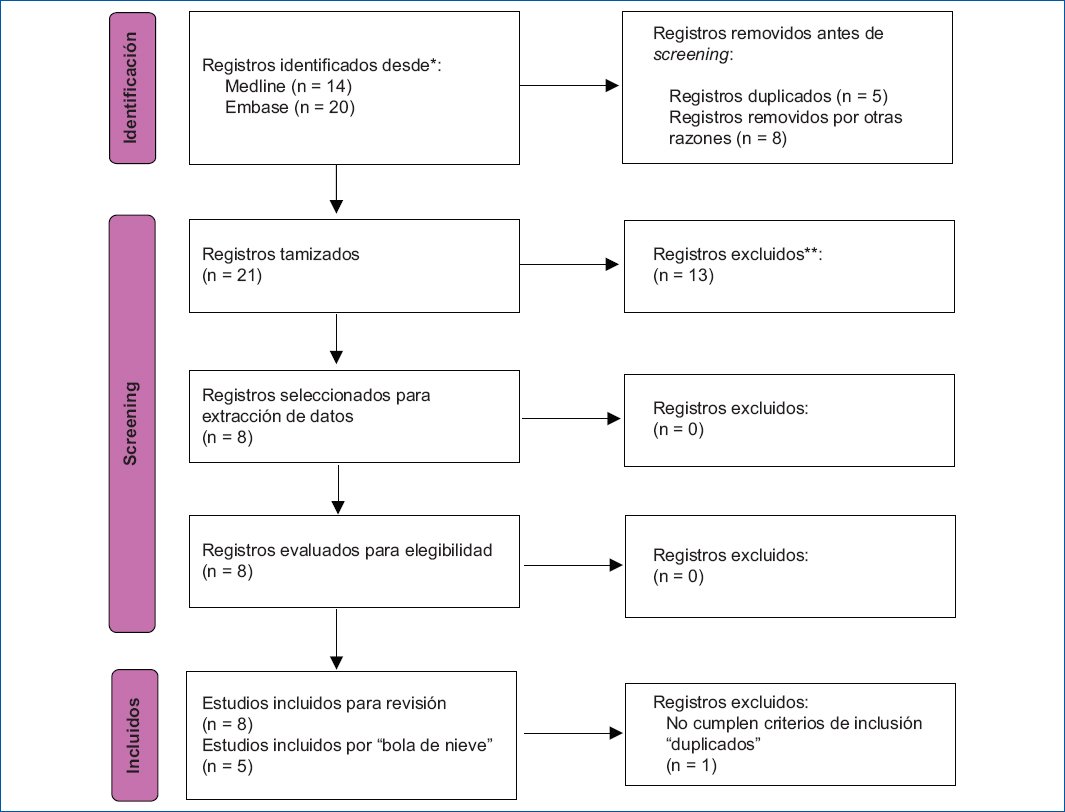
Figura 1. Flujograma PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses). **Excluidos por tipo de estudio diferentes a ensayos clínicos aleatorizados, tipo de población (enfermedad metastásica), tipo o estadio tumoral.
Los estudios seleccionados y analizados son todos ensayos clínicos aleatorizados multicéntricos que incluyeron población de Norteamérica, Suramérica, Europa, Oceanía y Asia; solo seis estudios incluyeron algunos pacientes provenientes de población latinoamericana. En general los pacientes incluidos tenían historia de CR localizado (pT1, pT2), localmente avanzado (pT3, pT4, N+) o metastásico (M+) tratado sin enfermedad residual evidente (pacientes con cirugía renal y metastasectomía sin evidencia de enfermedad residual) y que además evaluaron la eficacia oncológica del tratamiento adyuvante con inhibidores de puntos de control (checkpoint) inmunológico o de tirosina cinasa en estos contextos clínicos con inicio de la terapia en las primeras 12 semanas posteriores a la cirugía. Los criterios de inclusión de los estudios analizados se resumen en la tabla 1.
Tabla 1. Criterios de inclusión de los estudios analizados
| Estudio | Fármaco | Criterios de inclusión |
|---|---|---|
| ATLAS11 | Axitinib | > 18 años |
| CRCC predominante (> 50% en histología) | ||
| > pT2, Nx/N+, M0, ECOG 0/1 | ||
| Cualquier Furhman | ||
| Tratados con nefrectomía radical o parcial | ||
| PROTECT12,13 | Pazopanib | > 18 años |
| CRCC predominante | ||
| Cualquier Furhman | ||
| pT2G3-4, N0 | ||
| pT3-T4, cualquier G, N0 | ||
| Cualquier pT cualquier G, N1 | ||
| M0 | ||
| Karnosfky ≥ 80 | ||
| Tratados con nefrectomía radical o parcial | ||
| ECOG-ACRIN14 E2805/ASSURE | Sunitinib/sorafenib | CRCC y CRnCC resecado |
| pT1b G3-G4 N0M0 | ||
| Cualquier pT, cualquier G, N+, M0 | ||
| ECOG 0-1 | ||
| CheckMate91415 | Nivolumab+ipilimumab | > 18 años |
| CRCC predominante | ||
| Se admiten características sarcomatoides | ||
| pT2a, G3 o G4, N0 M0 | ||
| pT2b, cualquier G, N0 M0 | ||
| pT3, (a, b, c), cualquier G, N0 M0 | ||
| pT4, cualquier G, N0 M0 | ||
| Cualquier pT, cualquier G, N1 M0 | ||
| Tratados con nefrectomía radical o parcial | ||
| ECOG 0-1 | ||
| S-TRACT16,17 | Sunitinib | > 18 años |
| CRCC predominante | ||
| pT3-T4, N0-Nx, M0 | ||
| Cualquier pT, N+, M0 | ||
| Sin evidencia de enfermedad residual | ||
| Tratados con nefrectomía radical o parcial | ||
| ECOG 0-2 | ||
| ARISER18 | Girentixumab | > 18 años |
| CRCC (> 25% en histología) | ||
| Uno de los siguientes criterios: | ||
| pT1b, N0/NX, M0, grado ≥ 3 | ||
| pT2, N0/NX, M0, grado ≥ 3 | ||
| pT3a-3c, N0/NX, M0 | ||
| pT4, N0/NX, M0 | ||
| Cualquier T, N +, M0 | ||
| ECOG 0-1 | ||
| Tratados con nefrectomía radical o parcial | ||
| IMmotion01019 | Atezolizumab | > 18 años |
| CRCC con o sin características sarcomatoides. | ||
| T2, Grado 4 | ||
| T3a, Grado 3 o 4 | ||
| T3b-c, cualquier grado | ||
| T4, cualquier grado | ||
| TxN1, cualquier grado | ||
| M1 con metastasectomía sin evidencia de enfermedad | ||
| No haber recibido terapia sistémica previa | ||
| ECOG 0-1 | ||
| Aleatorización antes de 12 semanas desde la cirugía | ||
| KEYNOTE-56420–22 | Pembrolizumab | > 18 años CRCC con o sin características sarcomatoides |
| CRCC riesgo intermedio (pT2, Grado 4 o sarcomatoide, N0, M0 o pT3, cualquier grado, N0, M0) | ||
| CRCC alto riesgo (pT4, cualquier grado N0, M0 o pT cualquier estadio, cualquier grado, N+, M0) | ||
| CRCC M1 sin evidencia de enfermedad (metástasis sólida o en tejidos blandos resecada de forma sincrónica o metacrónica a la nefrectomía) | ||
| No haber recibido terapia sistémica previa | ||
| Tratados con nefrectomía parcial/radical y/o metastasectomía con bordes quirúrgicos negativos | ||
| ECOG 0-1 | ||
| Aleatorización antes de 12 semanas desde la cirugía | ||
|
CRCC: carcinoma renal células claras; CRnCC: carcinoma renal no de células claras; ECOG: eastern cooperative oncology group perfomance status; TNM: the eighth edition (2017) of the American Joint Committee on Cancer TNM classification. |
||
La tabla 2 resume los datos de interés obtenidos. Es preciso resaltar la heterogeneidad de los resultados, ya que los beneficios clínicos en términos de supervivencia general y de supervivencia libre de progresión o de enfermedad son discordantes entre las moléculas evaluadas; se debe mencionar también la alta proporción de efectos adversos descritos en las poblaciones estudiadas.
Tabla 2. Resumen datos de interés obtenidos desde los estudios analizados en contexto de adyuvancia para carcinoma renal
| Autor, país año, patrocinador, estudio | Población (n) | Países | Intervención | Seguimiento | Desenlaces | Efectos adversos | |
|---|---|---|---|---|---|---|---|
| 1 | Gross-Goupil et al., Francia, 2018, Pfizer ATLAS11 | 363: axitinib 361: placebo | Francia Corea del Sur Japón China EE.UU. Italia España | Axitinib 5 mg VO dos veces por día durante 1 a 3 años, o hasta progresión | 5 años | Supervivencia libre de enfermedad: HR: 0,87 (IC 95%: 0,66-1,14; p = 0,32) Supervivencia general: HR: 1,02 (IC 95%: 0,60-1,75; p = 0,92) | Mayores a grado 3: axitinib 61% vs. placebo 30% |
| 2 | Motzer et al., EE.UU., 2017, Novartis PROTECT12 | 571: pazopanib 600 mg 564: placebo 198: pazopanib 800 mg 205: placebo | EE.UU. Dinamarca Francia Rusia Corea del Sur República Checa Canadá Alemania Irlanda Reino Unido Suiza Italia | Pazopanib 800 mg VO cada día durante un año; se permitió reducción de dosis a 600 mg/día | 30,4 meses (600 mg) 47,9 meses (800 mg) | Supervivencia libre de enfermedad: HR (600 mg): 0,86 (IC 95%: 0,70-1,06; p = 0,16) HR (800 mg): 0,69 (IC 95%: 0,51-0,94; p = 0,02) Supervivencia general: HR (600 mg): 0,79 (IC 95%: 0,57-1,09; p = 0,16) HR (800 mg): 0,89 (IC 95%: 0,54-1,46; p = 0,65) | Cualquiera: pazopanib 98% vs. placebo 90% Grado 3 o 4: pazopanib 60% vs. placebo 21% |
| 3 | Motzer et al., EE.UU., 2021, Novartis PROTECT13 | 769: pazopanib 769: placebo | EE.UU. Dinamarca Francia Rusia Corea del Sur República Checa Canadá Alemania Irlanda Reino Unido Suiza Italia | Pazopanib 800 mg VO cada día durante un año; se permitió reducción de dosis a 600 mg/día | 76 meses | Supervivencia general: HR: 1,0 (IC 95%: 0,80-1,26; p = 0,9) | No disponible |
| 4 | Hass et al., EE.UU., 2016, National Cancer Institute (ECOG-ACRIN E2805/ASSURE)14 | 647: sunitinib 649: sorafenib 647: placebo | EE.UU. Canadá | Sunitinib 50 mg VO cada día, ciclos ON/OFF 4 x 2 semanas durante 1 año o Sorafenib 400 mg VO dos veces al día durante 1 año | 5,8 años | Supervivencia general a 5 años: 77,9% sunitinib vs. 80,5% sorafenib vs. 80,3% placebo Supervivencia libre de enfermedad: Mediana: sunitinib 70 meses vs. sorafenib 73,4 | Mayores a grado 3: sunitinib 63% vs. sorafenib 72% vs. placebo 25% |
| meses vs. placebo 79,6 meses HR sunitinib 1,02 (IC 97,5%: 0,85-1,23; p = 0,80) HR sorafenib 0,97 (IC 97,5%: 0,80-1,17; p = 0,71) | |||||||
| 5 | Motzer et al., EE.UU., 2023, Bristol Myers Squibb CheckMate 91415 | 405: nivolumab-ipilimumab 411: placebo | EE.UU. Alemania Japón Polonia Italia Francia Australia China Argentina Canadá España Países Bajos Reino Unido | Nivolumab 200 mg IV cada 2 semanas x 12 dosis + Ipilimumab 1mg/Kg IV cada 6 semanas x 4 dosis | 37 meses | Supervivencia libre de enfermedad: HR: 0,92; (IC 95%: 0,71-1,19; p = 0,53) 24 meses: 76% nivolumab + ipilimumab vs. 74% placebo | Grado 3 o 4: nivolumab-ipilimumab 38% vs. placebo 10% Muertes: nivolumab-ipilimumab n = 4 vs. placebo n = 0 |
| 6 | Ravaud et al., Francia, 2016, Pfizer S-TRACT16 | 309: sunitinib 306: placebo | EE.UU. Francia Reino Unido Taiwan Dinamarca Alemania Italia Polonia Eslovaquia | Sunitinib 50 mg VO cada día, ciclos ON/OFF 4 x 2 semanas durante 1 año | 5,4 años | Supervivencia libre de enfermedad: sunitinib: 6,8 años vs. placebo: 5,6 años HR: 0,76 (IC 95%: 0,59-0,98; p = 0,03) Supervivencia general: HR: 1,01 (IC 95%: 0,72-1,44; p = 0,94) | Grado 3: sunitinib 48,4% vs. placebo 15,8% Grado 4: sunitinib 12,1% vs. placebo 3,6% |
| 7 | Motzer et al., EE.UU., 2018, Pfizer S-TRACT17 | 309: sunitinib 306: placebo | EE.UU. Francia Reino Unido Taiwan Dinamarca Alemania Italia Polonia Eslovaquia | Sunitinib 50 mg VO cada día, ciclos ON/OFF 4 x 2 semanas durante 1 año | 6,6 años | Supervivencia libre de enfermedad en pacientes de alto riesgo: HR: 0,74 (IC 95%: 0,55-0,99; p = 0,04) Supervivencia general: HR: 0,92 (IC 95%: 0,66-1,28; p = 0,6) | No disponible |
| 8 | Chamie et al., EE.UU., 2017, Heidelberg Pharma ARISER18 | 433: girentuximab 431: placebo | EE.UU. Alemania Reino Unido Argentina Canadá Rusia Finlandia Brasil | Girentuximab 50 mg IV dosis inicial, seguida de 20 mg IV semanal entre la semana 2 y 24 | 54,1 meses | Supervivencia libre de enfermedad: HR: 0,97 (IC 95%: 0,79-1,18; p = 0,74) Supervivencia general: HR: 0,99 (IC 95%: 0,74-1,32; p = 0,94) | Mayores a grado 3: girentuximab 12% vs. placebo 11% |
| 9 | Pal et al., EE.UU., 2022, Roche Group IMmotion 01019 | 390: atezolizumab 388: placebo | EE.UU. Canadá Dinamarca España Francia Japón Brasil Italia Ucrania Reino Unido Países Bajos Irlanda Serbia Alemania Chile Bélgica Argentina Israel Turquía Taiwán Austria Tailandia Polonia | Atezolizumab 1200 mg IV cada 3 semanas durante 16 ciclos o hasta 1 año. | 44,7 meses | Supervivencia libre de enfermedad: HR: 0,93 (IC 95%: 0,75-1,15; p = 0,50) Muerte: HR: 0,97 (IC 95%: 0,67-1,42) | Grado 3 o 4: atezolizumab 27% vs. placebo 21% |
| 10 | Choureri et al., EE.UU., 2021, Merck KEYNOTE-56420 | 496: pembrolizumab 498: placebo | EE.UU. Polonia Corea del Sur Reino Unido Australia República Checa Taiwán Chile Francia Rusia Japón Brasil Canadá | Pembrolizumab 200 mg IV cada 3 semanas x 17 ciclos o hasta recurrencia. | 24,1 meses | Recurrencia: HR: 0,68 (IC 95%: 0,53-0,87; p = 0,002) Muerte: HR: 0,53 (IC 95%: 0,30-0,96; p = 0,002) Supervivencia a 24 meses: pembrolizumab 77,3% (IC 95%: 72,8-81,1%) vs. placebo 68,1% (IC 95%: 63,5-72,2%) | Mayores a grado 3: 32,4% pembrolizumab vs. 17,7% placebo |
| 11 | Powles et al., EE.UU., 2022., Merck KEYNOTE-56421 | 496: pembrolizumab 498: placebo | Ver fila 1 | Pembrolizumab 200 mg IV cada 3 semanas x 17 ciclos o hasta recurrencia. | 30,1 meses | Supervivencia libre de enfermedad: HR: 0,63 (IC 95%: 0,50-0,80) Supervivencia a 30 meses: pembrolizumab 75,2% (IC 95%: 70,8-79,1%) vs. placebo 65,5% (IC 95%: 60,9-69,7%) Supervivencia general: HR: 0,52 (IC 95%: 0,31-0,86; p = 0,000095) Recurrencia local: pembrolizumab 4% vs. placebo 7% Supervivencia libre de metástasis: HR: 0,63 (IC 95%: 0,49-0,82) | Mayores a grado 3: 32% pembrolizumab vs. 17% placebo |
| 12 | Choureri et al., EE.UU., 2024, Merck KEYNOTE-56422 | 496: pembrolizumab 498: placebo | EE.UU. Polonia Corea del Sur Reino Unido Australia República Checa Taiwán Chile Francia Rusia Japón Brasil Canadá | Pembrolizumab 200 mg IV cada 3 semanas x 17 ciclos o hasta recurrencia. | 57,2 meses | Supervivencia libre de enfermedad: HR: 0,72 (IC 95%: 0,59-0,87) Supervivencia libre de enfermedad a 48 meses: pembrolizumab 64,9% (IC 95%: 60,3-69,1%) vs. placebo 56,6% (IC 95%: 52,0-60,9%) Supervivencia a 48 meses: pembrolizumab 91,2% (IC 95%: 88,3-93,4%) vs. placebo: 86% (IC 95%: 82,6-88,8%) Supervivencia general: HR: 0,62 (IC 95%: 0,44-0,87; p = 0,005) Recurrencia: pembrolizumab (161/496) 32,46% vs. placebo (210/498) 42,17% Supervivencia libre de metástasis: HR: 0,63; (IC 95%: 0,49-0,82) | Mayores a grado 3: 18,6% pembrolizumab vs. 1,2% placebo Mediados-respuesta inmunitaria o reacciones infusionales: 36,5% pembrolizumab vs. 7,3% placebo |
|
HR: hazard ratio; IC: intervalo de confianza; IV: intravenoso; VO: vía oral. |
|||||||
La evaluación del riesgo de sesgos resultó en bajo riesgo para los dominios referentes al proceso de aleatorización, efecto de la asignación de la intervención y datos faltantes en todos los artículos. Para el riesgo de sesgos en la medición del desenlace hubo algunas preocupaciones en el estudio de Haas et al.14, en los demás casos hubo bajo riesgo. El riesgo de sesgos en la selección del resultado reportado resultó con algunas preocupaciones para el estudio de Motzer et al.17 y Pal et al.19; los demás manuscritos resultaron con riesgo bajo en este dominio (Tabla 3).
Tabla 3. Evaluación de riesgo de sesgos (RoB2). Análisis por intención de tratar
| Autor, año | Dominio 1: proceso de aleatorización | Dominio 2: efecto de asignación de la intervención | Dominio 3: datos faltantes | Dominio 4: medición del desenlace | Dominio 5: selección del resultado reportado | Evaluación global del riesgo de sesgos |
|---|---|---|---|---|---|---|
| Gross-Goupil et al., 201811 | ||||||
| Motzer et al., 201712 | ||||||
| Motzer et al., 202113 | ||||||
| Haas et al., 201614 | ||||||
| Motzer et al., 202315 | ||||||
| Ravaud et al., 201616 | ||||||
| Motzer et al., 201817 | ||||||
| Chamie et al., 201718 | ||||||
| Pal et al., 202219 | ||||||
| Choueiri et al., 202120 | ||||||
| Powles et al., 202221 | ||||||
| Choueiri et al., 202422 | ||||||
|
La evaluación no tuvo estudios de alto riesgo de sesgo. |
||||||
Discusión
Las experiencias clínicas registradas y, por lo tanto, el nivel de certeza de la evidencia23 disponible, permite inferir que en la actualidad no es aconsejable el uso de inhibidores de la tirosina cinasa como el pazopanib, el sorafenib o el axitinib como estrategia de adyuvancia en pacientes con tumor renal localizado y riesgo de recurrencia o progresión tumoral, ya que no se evidenciaron beneficios en términos de desenlaces oncológicos de interés (supervivencia libre de enfermedad o progresión), ni tampoco en la supervivencia general de las poblaciones estudiadas con este tipo de moléculas.
El sunitinib es el único medicamento de los inhibidores de la tirosina cinasa que ha mostrado beneficios en términos de supervivencia libre de enfermedad en el mediano plazo, por lo cual su uso ha sido aprobado por las agencias regulatorias de EE.UU. como estrategia de adyuvancia para pacientes con tumor renal localizado tras la nefrectomía24. Sin embargo, es preciso mencionar la alta tasa de efectos adversos registrados en los estudios clínicos, ya que entre el 48 y 63% de pacientes sometidos a esta terapia desarrollaron efectos adversos grado 3 o 4 durante el tratamiento y requirieron ajustes o minimización de dosis.
Los efectos adversos más frecuentes descritos en pacientes sometidos a esta terapia fueron:
- – Eritrodisestesia palmo-plantar.
- – Hipertensión arterial.
- – Fatiga.
- – Neutropenia.
Es preciso también mencionar que ninguno de los estudios disponibles utilizando sunitinib como estrategia de adyuvancia ha demostrado mejoría en el desenlace principal de supervivencia general respecto al uso de placebo. Este hecho constituye la principal razón teórica que genera interrogantes respecto a su uso en escenarios de adyuvancia para carcinoma renal de células claras localizado con alto riesgo de recurrencia. Una revisión sistemática reciente demostró que el uso de sunitinib como adyuvancia respecto al placebo tiene un hazard ratio (HR) de 5,20 (intervalo de confianza del 95% [IC 95%]: 4,10-6,59; p < 0,00001) para el desarrollo de efectos adversos y no encontró diferencias en supervivencia general (HR: 0,93; IC 95%: 0,83-1,04; p = 0,74), ni en la supervivencia libre de enfermedad en pacientes con alto riesgo (HR: 0,91; IC 95%: 0,82-1,02; p = 0,10) comparado con el placebo25.
El uso de estrategias de inmunomodulación con atezolizumab o con la combinación de anticuerpos anti-PD-L1 y anti-CTLA 4 o con el uso de anticuerpos monoclonales dirigidos a la anhidrasa carbónica tipo IX expresada en las células tumorales renales no ha demostrado resultados con aplicabilidad o utilidad clínica, por lo tanto su uso en este escenario clínico tampoco es aconsejable26.
Los resultados más recientes con pembrolizumab han abierto una alternativa que demostró mejoría en la supervivencia libre de enfermedad y supervivencia general en el mediano plazo (seguimiento a 57 meses) con un perfil de seguridad más favorable que el de las otras moléculas estudiadas; los principales efectos secundarios registrados con este medicamento han sido el desarrollo de hipertensión arterial y la elevación de la alanina aminotransferasa, que afectaron hasta al 12% de pacientes. El análisis por subgrupos demostró que bajo los criterios de inclusión (Tabla 1) el beneficio en términos de supervivencia general parece favorecer a pacientes de sexo masculino, < 65 años, de raza blanca, ECOG (Eastern Cooperative Oncology Group) 0, con score combinado PD-L1 ≥ 1, M0, riesgo intermedio-alto, sin características sarcomatoides y de poblaciones diferentes a la proveniente de los EE.UU.22.
Es preciso mencionar que en el grupo de pacientes sometidos a terapia con pembrolizumab se registró una recurrencia tumoral del 32,46%; de ellas el 15,5% fue local y más del 80% fueron casos de recaída sistémica. También debe mencionarse que a la fecha solo se conocen estudios iniciales de su perfil de costo-efectividad en el sistema de aseguramiento en salud de EE.UU.27.
La información disponible respecto a la historia natural del CR en contexto de enfermedad localizada estratificada según su grupo de riesgo muestra que a 5 años de seguimiento la supervivencia general es del 83,8% ± 4,3, 71,9% ± 4,1 y 44,0% ± 5,0 y la supervivencia libre de enfermedad es del 91,1% ± 3,6, 80,4% ± 4,0 y 54,7% ± 5,4 para pacientes de riesgo bajo, intermedio y alto respectivamente28. Además, se han planteado factores asociados a riesgo competitivo de muerte en pacientes con CR localizado29, por lo que se podría considerar que en este grupo poblacional aún hacen falta resultados para definir, con la menor interferencia y sesgo posible, si el uso de pembrolizumab puede ser superior al estándar de cuidado actual constituido por la cirugía renal y la observación clínica, y si brinda beneficios aplicables a diversas poblaciones en el largo plazo. Sin embargo, los datos disponibles con análisis de desenlaces oncológicos en seguimiento de 48 meses son promisorios y prevén buenos resultados oncológicos de esta molécula en el contexto de la adyuvancia para CR de células claras localizado en el subgrupo de pacientes ya mencionado30.
En la actualidad las guías más recientes de la National Comprehensive Cancer Network31 apoyan el uso del pembrolizumab como estrategia de adyuvancia en pacientes con CR localizado o tratados con cirugía y con alto riesgo de recurrencia o progresión tumoral (tumores de células claras grado 4 o con diferenciación sarcomatoide); también los hacen las guías de la European Society for Medical Oncology32 sin graduación de la recomendación, y las guías de la Asociación Europea de Urología en su más reciente versión33 dan una recomendación débil para el uso de pembrolizumab como estrategia de adyuvancia en pacientes con criterios del estudio KEYNOTE-564.
Esta scoping review pone de manifiesto que la mayoría de las moléculas estudiadas no son eficaces en el manejo adyuvante del paciente con CR localizado, así como la ausencia de representación significativa en los estudios de población latinoamericana, africana y de gran parte de Asia (excepto Asia Oriental) por su casi nula representación en los estudios primarios evaluados. Este hallazgo asume relevancia ante la posible no aplicabilidad de los resultados obtenidos en las poblaciones sin representación en la data disponible y abre también una discusión sobre una necesidad clínica relevante para países en vías de desarrollo, ya que es necesario implementar estrategias de investigación que permitan explorar los potenciales resultados positivos de las moléculas de interés (sunitinib, pembrolizumab) para definir su aplicabilidad y potencial beneficio clínico en poblaciones ampliadas y menos favorecidas.
Se evidenció también que la gran mayoría de la investigación clínica en el contexto de estrategias de adyuvancia en el tratamiento del CR de células claras ha sido financiada y respaldada por la industria farmacéutica. Este seguramente ha sido un motor que ha permitido superar las barreras de las fronteras, que ha garantizado la disponibilidad de las moléculas en estudio y que ha permitido obtener resultados clínicos con utilidad en el contexto del CR de células claras, sin embargo este es un hecho con connotaciones éticas relevantes34 que debe ser analizado de forma crítica y consciente por las agencias regulatorias y los profesionales de la salud, para garantizar que los resultados descritos no se traduzcan en un uso irracional de estrategias farmacológicas fútiles35,36 y potencialmente peligrosas para el cuidado del paciente con CR localizado.
A la fecha de elaboración de este manuscrito la autoridad regulatoria en Colombia no tiene aprobación para uso de ninguna de estas moléculas en el contexto de adyuvancia para CR localizado o localmente avanzado37 y la discusión mundial parece respaldar el uso de adyuvancia con pembrolizumab en pacientes con CR localizado con alto riesgo de recaída/progresión clínica38.
Esta revisión de alcance tiene la limitación de incluir estudios primarios con seguimientos heterogéneos pero que en general se enmarcan en el corto y mediano plazo, y además de reflejar datos de poblaciones en su mayoría correspondientes a países desarrollados; sin embargo, consolida las experiencias mundiales más sobresalientes en términos de estudios clínicos aleatorizados respecto a la adyuvancia en CR de células claras localizado con riesgo intermedio o alto de recurrencia. Además, cuenta como fortaleza con el análisis de sesgos de los estudios primarios, por lo tanto, le permite al lector tener un panorama claro y conciso de los resultados clínicos de interés que se han alcanzado en estas investigaciones durante los últimos años.
Conclusiones
El sunitinib es la única molécula del grupo de inhibidores de la tirosina cinasa que ha mostrado resultados favorables, con certeza moderada en la evidencia, en términos de supervivencia libre de enfermedad, sin embargo no tiene impacto en la supervivencia general y genera una alta proporción de efectos adversos. El pembrolizumab es la única molécula que ha demostrado efectos positivos en supervivencia libre de enfermedad y supervivencia general en el corto y mediano plazo en subgrupos de pacientes con CR de células claras localizado con riesgo intermedio-alto de recurrencia; se requiere aumentar el seguimiento, madurar la data y ampliar las poblaciones incluidas en los estudios primarios para definir su potencial aplicabilidad clínica en todos los subgrupos de pacientes con CR localizado.
Financiamiento
Los autores declaran que este trabajo se realizó con recursos propios.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.

 Bajo riesgo de sesgo
Bajo riesgo de sesgo Algunas preocupaciones
Algunas preocupaciones Alto riesgo de sesgos
Alto riesgo de sesgos