Introducción
La estimación del volumen prostático (PV) en la hiperplasia prostática benigna (HPB) es fundamental para el diagnóstico preciso, estratificación del riesgo y plan de tratamiento. Se emplean varios métodos para medir el volumen, como el examen rectal digital (DRE), la ecografía transabdominal (TAUS), la ecografía transrectal (TRUS) y la resonancia magnética (RM)1,2. El DRE, aunque es menos preciso, se utiliza con frecuencia debido a su accesibilidad; los estudios han demostrado que el DRE según la experiencia del urólogo, podría aproximarse a las mediciones de la TRUS, lo que lo convierte en una herramienta razonable para la evaluación inicial3,4. La TRUS se considera el estándar de referencia para la estimación del PV, pero se ha observado que subestima el volumen, especialmente en próstatas grandes, además es incómoda y podría aumentar los costos5. La RM, por otro lado, ha demostrado una alta precisión y correlación con el peso real de la próstata, lo que la convierte en un método valioso para la práctica clínica, especialmente cuando la medición precisa del volumen es fundamental para la planificación terapéutica6. La fórmula elipsoide, comúnmente utilizada tanto en las ecografías como en la RM, ha demostrado concordancia entre métodos y reproducibilidad, aunque tiende a sobreestimar el PV en la RM y a subestimarlo en la ecografía6. La correlación entre el PV y el valor del antígeno prostático específico (PSA) también se ha estudiado, considerando que el aumento del volumen presupone niveles más altos de PSA, lo que sugiere una correlación con el PV7,8. Además, las mediciones antropométricas, como el peso corporal y el índice de masa corporal, junto con el PSA y el porcentaje de PSA libre, se han incorporado a los modelos predictivos y nomogramas para estimar el PV, lo que mejora la precisión de las evaluaciones no invasivas9. La estimación precisa del PV es esencial para seleccionar las modalidades de tratamiento adecuadas, ya sean farmacológicas o intervenciones quirúrgicas10. Asimismo, comprender la relación entre el volumen, el PSA y las puntuaciones de los síntomas (puntuación internacional de síntomas prostáticos [IPSS]) puede ayudar a trazar planes de tratamiento individualizados, lo que podría reducir los costos de atención médica al evitar tratamientos innecesarios en pacientes con bajo riesgo de complicaciones8.
Es indispensable reconocer que el PV es un factor crítico en la planificación quirúrgica de la HPB, ya que influye en la elección de la técnica quirúrgica y la predicción de los resultados quirúrgicos11. Por ejemplo, la fórmula 1,082 × Edad + 0,523 × AUS − 53,845 se ha validado para mejorar la estimación del PV mediante TAUS, lo que lleva a predicciones precisas del peso de los tejidos12. La TRUS ha demostrado ser un método confiable y rentable que se correlaciona estrechamente con el peso real de las muestras quirúrgicas13,14. Para las próstatas grandes, los tratamientos quirúrgicos abiertos, como la prostatectomía transvesical suprapúbica, han demostrado ser eficaces y seguros, con mejoras significativas en las tasas de flujo urinario y la puntuación de los síntomas después de la operación15. El volumen de la zona de transición medido por TRUS es particularmente preciso para predecir el peso del tejido resecado, lo que lo convierte en una herramienta valiosa en el tratamiento clínico y la planificación quirúrgica, y esto parece extrapolable a la evaluación mediante TAUS16. No se cuenta con evidencia sólida de la correlación directa entre el tamaño de la próstata y la gravedad de los síntomas, pero la medición precisa del volumen, como se mencionó previamente, es crucial para la planificación quirúrgica y mejora los resultados quirúrgicos17,18. Por lo tanto, el PV es un factor fundamental en la planificación quirúrgica de la HPB, ya que influye en la elección de la técnica quirúrgica y la preparación preoperatoria, así como para seleccionar las modalidades de tratamiento adecuadas10.
La TAUS es un método ampliamente utilizado para estimar el volumen de la próstata debido a sus ventajas, como portabilidad, bajo costo y capacidad de operación en tiempo real19. Los estudios han demostrado que la TAUS proporciona un alto grado de correlación y confiabilidad con coeficientes de correlación (r) de 0,838 y coeficientes de correlación intraclase de 0,83; sin embargo, la TAUS tiende a sobrestimar el PV en una media de 2,4 ml, aunque esta diferencia suele ser independiente del volumen real de la muestra20. En la práctica clínica, se estima que la TAUS correlaciona bien con la puntuación IPSS, lo que indica su utilidad para evaluar la gravedad de los síntomas21. A pesar de sus beneficios, las mediciones de la TAUS suelen ser mayores que las obtenidas mediante TRUS, y un estudio informó que las mediciones de la TAUS fueron mayores en el 57% de los casos22. Esta discrepancia sugiere que la TAUS y la TRUS no pueden usarse indistintamente. Además, la TAUS tiende a sobreestimar el PV en aproximadamente 9,9 ml en comparación con la TRUS, lo que podría afectar la toma de decisiones clínicas8,23. La precisión de la TAUS puede verse influenciada por el volumen de la vejiga durante el examen, y los estudios indican que un volumen vesical de 50 a 99 ml es suficiente para medir con precisión el volumen de la próstata, lo que podría reducir las molestias del paciente asociadas con la vejiga llena24. Se ha procurado mejorar la precisión de la TAUS, como el uso de un nuevo coeficiente en la fórmula de estimación del volumen, lo cual podría obtener mediciones más precisas del PV25. En general, si bien la TAUS es un método fiable y práctico para estimar el PV, su rendimiento diagnóstico debe interpretarse con cautela y ajustarse al contexto específico donde se utilice26,27. El objetivo del presente estudio fue evaluar la correlación entre el PV obtenido por TAUS y la pieza anatomopatológica posterior a la realización de prostatectomía abierta.
Método
Se realizó un estudio retrospectivo observacional analítico y de correlación, en el cual se incluyeron 417 pacientes con diagnóstico de HPB, con indicación quirúrgica de prostatectomía abierta, que debían contar con reporte en historia clínica de TAUS y reporte anatomopatológico de la pieza quirúrgica entre los años 2015 y 2022; se excluyeron los pacientes con diagnóstico de cáncer de próstata, pacientes con cualquier patología abdominal que limitara la visualización de la próstata por TAUS y pacientes que tuvieran indicación quirúrgica de prostatectomía transuretral.
La recolección de los datos se realizó después de haber obtenido el aval del comité de ética institucional (código de aprobación CNC-GCA-IN-019-F001), esta investigación no requirió consentimiento informado de los participantes, dado que es investigación documental retrospectiva, por lo tanto, según la resolución 8430 de 1993 se considera un estudio sin riesgo. Los datos se obtuvieron por medio de la historia clínica de los pacientes y se registraron en una base de datos de Excel.
Para efecto de análisis fue necesario crear nuevas variables categorizadas, estas fueron: puntuación IPSS, que clasifica la intensidad de los síntomas en leve (0-7 puntos), moderada (8-19 puntos) o grave (20-35 puntos); los pacientes con antecedentes de enfermedad renal crónica se clasificaron en dos categorías, con insuficiencia renal (estadios 3, 4 y 5) y sin insuficiencia renal (estadio 1, 2 y sin antecedentes renales); el PSA se clasificó en cuatro categorías (< 4 ng/ml, entre 4 y 10 ng/ml y > 10 ng/ml). Los pacientes con DRE en grado 1 y 2 se clasificaron como próstatas < 50 g y los que estaban con reporte de DRE grado 3 y 4 se clasificaron como próstatas ≥ 50 g, se dividieron el DRE y el VP ecográfico en dos categorías (I-II y III-IV y < 70 cc y > 70 cc, respectivamente); el DRE se clasificó de la siguiente manera: I 20-30 cc, II 30-50 cc, III 50 80 cc y IV, > 80 cc. Se utilizó la medida de 70 cc como punto de corte porque es la empleada en la práctica diaria en nuestro servicio para clasificar a los pacientes para adenomectomía retropúbica o resección endoscópica28,29 (Tabla 1).
Tabla 1. Variables de interés categorizadas
| Variables |
|---|
| Puntuación internacional de los síntomas prostáticos |
| Leve |
| Moderado |
| Grave |
| Enfermedad renal crónica |
| Sin insuficiencia renal (sin antecedente renal y estadios 1 y 2) |
| Insuficiencia renal (estadio 3, 4 y 5) |
| Antígeno prostático específico |
| < 4 ng/dl |
| 4-10 ng/dl |
| > 10 ng/dl |
| Volumen prostático (tacto rectal) |
| Grado I: 20-29 cc |
| Grado II: 30-49 cc |
| Grado III: 50-80 cc |
| Grado IV: > 80 cc |
| Volumen prostático (unificado) |
| < 50 cc (grado I y II) |
| > 50 cc (grado III y IV) |
Se realizó un análisis descriptivo de las variables del estudio, en el caso de las categóricas o cualitativas tanto sociodemográficas como clínicas se presentaron mediante frecuencias absolutas y porcentajes. En las variables cuantitativas se contrastó la normalidad, mediante la prueba estadística de Kolmogorov-Smirnov. Se utilizó el promedio y la desviación estándar cuando se cumplió el supuesto de normalidad, y en el caso contrario se presentó la mediana y el rango intercuartílico. Todos los resultados se muestran por medio de tablas y figuras. Se realizó el análisis de correlación mediante el coeficiente de correlación de Pearson entre el PSA y el peso de la próstata medido por patología (g); la relación del PV medido por ecografía (cc) y el peso de la próstata medido por patología (g) se evaluó con las variables clínicas por medio de la prueba de Kruskal-Wallis y U de Mann-Whitney según era el caso, luego se realizó la conversión del peso en gramos (g) a centímetros cúbicos (cc), mediante la fórmula centímetros cúbicos = gramos/densidad. Se verificó el informe de radiología con la medición obtenida en las imágenes impresas de la ecografía por medio del software.
Posteriormente, se realizó el cálculo de la diferencia entre el tamaño de la próstata por ecografía (valor estimado) y el peso de la próstata por patología (valor real). Si las diferencias eran negativas se consideraba subestimación, por el contrario, si fueron positivas se consideraba sobreestimación. Luego se definió un punto de corte para establecer la sobreestimación mediante el método de «porcentaje de error máximo», el cual consiste en dividir la diferencia calculada anteriormente, sobre el valor estimado; a partir de esta división se definen dos categorías: aquellos que tenían una sobreestimación tolerable (< 10%) y los que tenían una sobreestimación clínicamente significativa (≥ 10%), obteniendo de esta manera la variable resultado del estudio (Fig. 1). En el análisis bivariante y multivariante se generó un modelo de regresión logística para evaluar las variables que estuvieran asociadas con la sobreestimación del PV. El análisis de datos se realizó por medio del software Stata Versión 17.
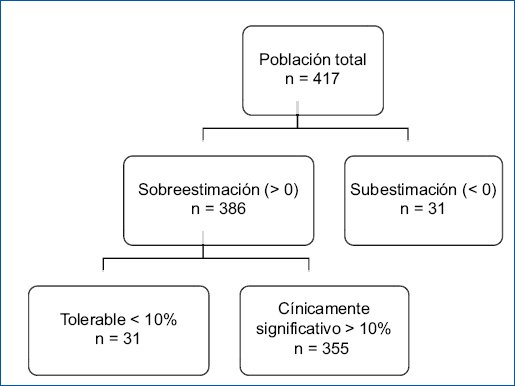
Figura 1. Clasificación de la sobreestimación.
Resultados
La edad promedio de los pacientes fue de 68,4 ± 8,1, el principal diagnóstico anatomopatológico fue hiperplasia glándula estromal (96,4%), de los cuales al 68,35% se les documentó prostatitis crónica en patología, presentaban IPSS grave (80,58%) (Fig. 2), con reporte de PSA entre 4-10 ng/ml (48,92%), tacto rectal grado II (49,64%), la mediana de tamaño de próstata por ecografía de 120 cc (90-151), el peso de pieza quirúrgica de 78 g (54-112), el 47,2% se encontraban con tratamiento farmacológico con alfabloqueador + inhibidor de la 5-alfa-reductasa y el 84,65% de los pacientes no presentaban antecedente insuficiencia renal, al igual que no presentaban cirugía prostática previa (89,45%) (Tabla 2). El coeficiente de correlación entre el PSA y el peso del espécimen quirúrgico fue de r: 0,12 (p = 0,0121) (Fig. 3).
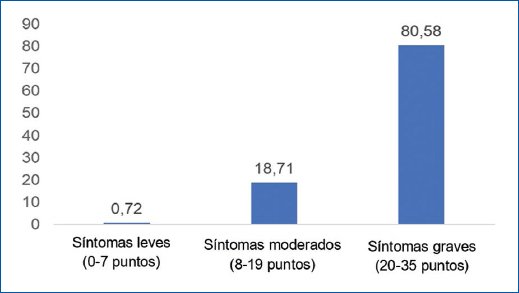
Figura 2. Caracterización de la puntuación internacional de síntomas prostáticos (IPSS).
Tabla 2. Caracterización sociodemográfica y clínica de la población
| Características | n | % |
|---|---|---|
| Modulo sociodemográfico | ||
| Edad promedio ± DE | 68,4 ± 8,1 | |
| Año cirugía | ||
| 2015 | 2 | 0,48 |
| 2016 | 88 | 21,1 |
| 2017 | 12 | 2,88 |
| 2018 | 2 | 0,48 |
| 2019 | 92 | 22,06 |
| 2020 | 58 | 13,91 |
| 2021 | 86 | 20,62 |
| 2022 | 77 | 18,47 |
| Módulo clínico | ||
| IPSS | ||
| Síntomas leves (0-7 puntos) | 3 | 0,72 |
| Síntomas moderados (8-19 puntos) | 78 | 18,71 |
| Síntomas severos (20-35 puntos) | 336 | 80,58 |
| Cirugía previa prostática | ||
| RTUP | 25 | 6 |
| Abierta | 19 | 4,56 |
| Ninguna | 373 | 89,45 |
| Estadio de insuficiencia renal | ||
| Estadio 1 | 17 | 4,08 |
| Estadio 2 | 61 | 14,63 |
| Estadio 3 | 37 | 8,87 |
| Estadio 4 | 16 | 3,84 |
| Estadio 5 | 11 | 2,64 |
| Ninguno | 275 | 65,95 |
| Insuficiencia renal | ||
| Sí | 64 | 15,35 |
| No | 353 | 84,65 |
| Antígeno prostático | ||
| < 4 ng/dl | 141 | 33,81 |
| 4-10 ng/dl | 204 | 48,92 |
| > 10 ng/dl | 72 | 17,27 |
| Módulo diagnóstico | ||
| Tamaño de próstata por ecografía (cc) | 120 (90-151) | |
| Mediana (RIQ) | ||
| Peso de próstata por patología (g) | 78 (54-112) | |
| Mediana (RIQ) | ||
| Diagnóstico por patología | ||
| Hiperplasia glándula estromal | 402 | 96,4 |
| Prostatitis crónica | 4 | 0,96 |
| Adenocarcinoma de próstata | 8 | 1,92 |
| ASAP | 3 | 0,72 |
| Prostatitis crónica en patología | ||
| Sí | 285 | 68,35 |
| No | 132 | 31,65 |
| Módulo de manejo | ||
| Tacto rectal | ||
| 1. Grado I | 45 | 10,79 |
| 2. Grado II | 207 | 49,64 |
| 3. Grado III | 115 | 27,58 |
| 4. Grado IV | 50 | 11,99 |
| Derivación con sonda uretral | ||
| Sí | 234 | 55,88 |
| No | 183 | 43,88 |
| Medicamentos | ||
| Alfabloqueador | 147 | 35,25 |
| Inhibidor 5-alfa-reductasa | 4 | 0,96 |
| Alfabloqueador + inhibidor de la 5-alfa reductasa | 197 | 47,24 |
| Ninguno | 69 | 16,55 |
|
ASAP: proliferación acinar focal atípica; DE: desviación estándar; IPSS: puntuación internacional de síntomas prostáticos; RIQ: intervalo intercuartílico; RTUP: resección transuretral de próstata. |
||
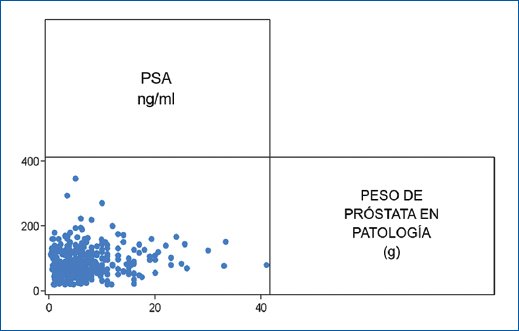
Figura 3. Correlación entre el antígeno prostático (PSA) y el peso de la próstata medido por patología.
Se evaluó la relación entre el tamaño (cc) y el peso (g) de la próstata, por medio de la prueba de Kruskal-Wallis y U de Mann-Whitney según sea el caso (Tabla 3), donde se obtuvo resultados estadísticamente significativos en relación con el peso con prostatitis crónica en patología (p = 0,0351), pacientes con tratamiento farmacológico (p = 0,02) y los pacientes con derivación de sonda uretral (p = 0,0001). Se realizó el análisis bivariante con la sobreestimación y las variables clínicas a las que se les realizó el modelo de regresión logística, donde se evidenció la insuficiencia renal (p = 0,264), el PSA > 10 ng/ml (p = 0,02), prostatitis en patología (p = 0,177), diferencia entre los tamaños de la próstata ≥ 50 (p = 0,103) (Fig. 4) y los pacientes que tuvieron derivación con sonda (p = 0,125).
Tabla 3. Relación entre el tamaño y el peso de la próstata (ambos en cc) con las variables clínicas
| Características | Total (417) | Tamaño cc | p | Peso cc | p | Diferencia en cc | p |
|---|---|---|---|---|---|---|---|
| IPSS | |||||||
| Síntomas leves (0-7 puntos) | 3 | 125 | 0,8262* | 64 | 0,9697* | 44 | 0,8602* |
| Síntomas moderados (8-19 puntos) | 78 | 120 | 80 | 41,5 | |||
| Síntomas graves (20-35 puntos) | 336 | 120 | 78 | 39 | |||
| Cirugía previa prostática | |||||||
| RTUP | 25 | 115 | 0,8938* | 79 | 0,4325* | 44 | 0,5634* |
| Abierta | 19 | 96 | 76 | 41 | |||
| Ninguna | 373 | 120 | 78 | 40 | |||
| Insuficiencia renal | |||||||
| Sí | 64 | 119 | 0,2895† | 70,5 | 0,3122† | 40,5 | 0,7318† |
| No | 353 | 120 | 80 | 40 | |||
| Antígeno prostático | |||||||
| < 4 ng/dl | 141 | 128 | 0,4231* | 73 | 0,0676* | 42 | 0,1589* |
| 4-10 ng/dl | 204 | 114 | 77 | 39 | |||
| > 10 ng/dl | 72 | 125,5 | 93 | 35,5 | |||
| Diagnóstico | |||||||
| Hiperplasia glándula estromal | 402 | 119,5 | 0,21* | 77,5 | 0,153* | 40 | 0,346* |
| Prostatitis crónica | 4 | 163,5 | 140 | 22 | |||
| Adenocarcinoma de próstata | 8 | 144 | 78,5 | 54 | |||
| ASAP | 3 | 132 | 90 | 42 | |||
| Prostatitis crónica en patología | |||||||
| Sí | 285 | 117 | 0,064† | 76 | 0,0351† | 41 | 0,563† |
| No | 132 | 129,5 | 80 | 36,5 | |||
| Medicamentos | |||||||
| Alfabloqueador | 147 | 120 | 0,177* | 81 | 0,02* | 40 | 0,156* |
| Inhibidor 5-alfa-reductasa | 4 | 81,5 | 27,5 | 52 | |||
| Alfabloqueador + inhibidor de la | 197 | 124 | 72 | 41 | |||
| 5-alfa-reductasa | 69 | 118 | 79 | 29 | |||
| Ninguno | |||||||
| Volumen próstatico unificado | |||||||
| Próstata < 50 | 252 | 117,5 | 0,057† | 71 | 0,0008† | 42 | 0,0274† |
| Próstata ≥ 50 | 165 | 124 | 86 | 35 | |||
| Derivación con sonda uretral | |||||||
| Sí | 234 | 125 | 0,009† | 85 | 0,0001† | 37 | 0,0316† |
| No | 183 | 115 | 69 | 43,8 | |||
|
* Prueba de Kruskal-Wallis. † Prueba U de Mann-Whitney. ASAP: proliferación acinar focal atípica; IPSS: puntuación internacional de síntomas prostáticos; RTUP: resección transuretral de próstata. |
|||||||
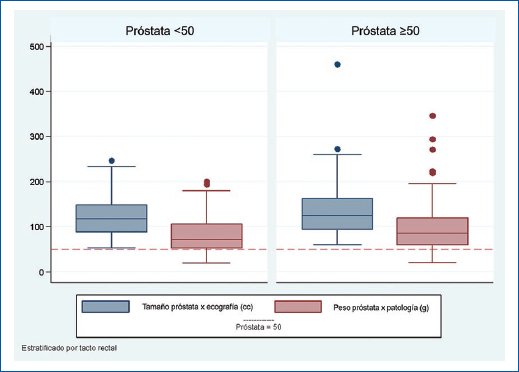
Figura 4. Relación de tamaño de próstata calculado por ecografía (cc) y peso de próstata por patología (g) con el volumen calculado por tacto rectal.
El modelo de regresión logística final ajustado evidenció que el PSA tuvo una asociación estadísticamente significativa con la sobreestimación (OR: 0.3; 95% CI 0.27-0.33, p = 0.020), esto significa que, según el modelo, un aumento en los niveles de PSA está asociado con una menor probabilidad de sobreestimación clínicamente significativa. La correlación entre el PV obtenido por ecografía transabdominal y la pieza anatomopatológica posterior a la realización de prostatectomía abierta fue de r: 0,73 (p < 0,5) (Fig. 5).
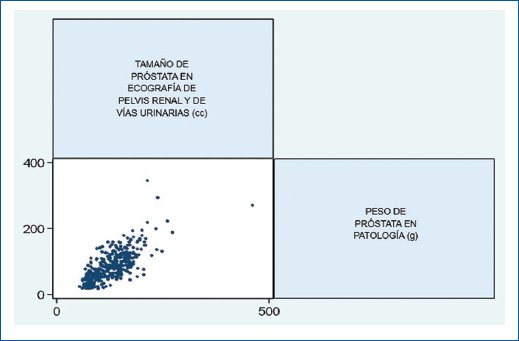
Figura 5. Correlación entre el volumen prostático obtenido por ecografía transabdominal y la pieza anatomopatológica posterior a la realización de prostatectomía abierta.
Discusión
En este estudio se analizaron las posibles correlaciones entre variables comúnmente medidas en los pacientes antes de la realización de prostatectomía, centrándose en la relación entre los volúmenes y pesos obtenidos27. Se identificaron algunos factores relacionados con el volumen obtenido por TAUS y el peso del espécimen quirúrgico prostático posterior a prostatectomía. En este estudio se encontró que la mayoría de los pacientes presentaban síntomas de IPSS grave (80,58%), los cuales están relacionados con el almacenamiento y la evacuación de la orina, un dato esperado dada la indicación de manejo quirúrgico28,29. Nuestros resultados en términos de gravedad de los síntomas son consistentes con los encontrados en la literatura. El valor de PSA, aunque no es una herramienta diseñada para la estimación del volumen, sabemos por distintos estudios que se correlaciona con la gravedad de los síntomas, la progresión de estos y la necesidad de intervención; asimismo, se confirma que, usualmente, los pacientes con patología benigna no superan los 10 ng/ml29,30.
En este estudio se obtuvieron datos del volumen por TAUS (cc) con una mediana de 120 cc, lo cual corrobora lo encontrado en distintas series, donde se indicó manejo quirúrgico con prostatectomía o equivalentes. Igualmente, se contrastaron los resultados con los distintos pesos reportados en los estudios citados31–34. Esto puede interpretarse como una fortaleza y abre la puerta a la validez externa del estudio.
Se encontró que la derivación con sonda uretral guarda una relación positiva con el tamaño estimado de la próstata por TAUS (p = 0,009) respecto al peso de los que se les practica este procedimiento (p = 0,0001), y es también una variable que afecta la sobreestimación del peso. Esto podría explicarse por varios factores: la sonda uretral puede distorsionar la anatomía de la próstata (sobredistensión por pinzamiento o baja distensión por no pinzar previamente), otra posible causa es que en estos pacientes el estudio se realice con protocolos modificados34–36. Los pacientes del estudio se encontraban en manejo farmacológico para la HPB previo a la cirugía y se evidenció disminución del tamaño de la próstata (p = 0,02), esto se puede explicar debido al mecanismo de acción que tiene cada grupo de medicamentos36.
Al evaluar la correlación entre el peso de la pieza quirúrgica y el valor del PSA, nuestro resultado fue de 0,12 (p = 0,0121), una conclusión similar a la de estudios comparables35–37. Obtuvimos una sobreestimación del 92,5% del PV medido por TAUS y el peso de la pieza quirúrgica, en comparación con el trabajo de Smith et al., donde se obtuvo una sobreestimación por TAUS del 55,7%36,37. Una de las razones que pueden explicar estos resultados es la experiencia de los examinadores y el tiempo destinado para el estudio, lo cual está relacionado con la calidad del estudio y puede afectar el resultado ecográfico. Además, las mediciones ecográficas del PV no necesariamente reflejarán con exactitud los resultados quirúrgicos, ya que el enfoque de la cirugía es específicamente en la eliminación del adenoma.
Conclusiones
Los datos obtenidos en este estudio son relevantes y suman evidencia para acercarnos a la mejor decisión clínica. La TAUS se correlaciona con el tamaño de la próstata, pero sobreestima el valor, por lo que esta modalidad diagnóstica no debería ser el único ni el más importante estudio para definir la técnica quirúrgica. Es indispensable la realización de estudios adicionales para sumar evidencia al respecto.
Financiamiento
Los autores declaran que la presente investigación no ha recibido ninguna beca específica de agencias de los sectores públicos, comercial o con ánimo de lucro.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores agradecen al Dr. Iregui por su orientación y su apoyo, que contribuyeron significativamente a mejorar la calidad de este trabajo. A la Universidad Libre Seccional Cali, por el apoyo educativo y logístico proporcionado por medio del proyecto y a la IPS de tercer nivel por permitir ejecutar este proyecto gracias al aporte de datos.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes. Además, los autores han reconocido y seguido las recomendaciones según las guías SAGER dependiendo del tipo y naturaleza del estudio.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Uso de inteligencia artificial para generar textos. Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.