Introducción
La vejiga hiperactiva (VH) es un trastorno del tracto urinario caracterizado por la urgencia urinaria, con o sin incontinencia, generalmente acompañada de frecuencia y nocturia. Se estima que afecta a un 10-15% de la población adulta mundial, y es más prevalente en mujeres y en pacientes mayores de 60 años1. Esta afección puede ser idiopática o asociada a trastornos neurológicos, como esclerosis múltiple, lesiones de la médula espinal o accidente cerebrovascular2.
El impacto de la VH en la calidad de vida de los pacientes es considerable, ya que los episodios de incontinencia pueden generar vergüenza, ansiedad y aislamiento social. Además, la nocturia y la frecuencia urinaria interfieren con el sueño y las actividades cotidianas. Los tratamientos de primera línea incluyen cambios en el estilo de vida, fisioterapia del suelo pélvico y medicación anticolinérgica o beta-3 agonista3. Sin embargo, hasta el 30% de los pacientes no responden adecuadamente a estos tratamientos o los abandonan debido a efectos adversos, como sequedad de boca, estreñimiento y deterioro cognitivo4.
En este contexto, la toxina botulínica tipo A (BoNT-A) ha surgido como una alternativa terapéutica efectiva para los pacientes con VH refractaria. La BoNT-A actúa bloqueando la liberación de acetilcolina en las terminales nerviosas colinérgicas, lo que reduce la contracción del músculo detrusor y disminuye los episodios de incontinencia5. Aunque la administración de BoNT-A se ha realizado tradicionalmente en quirófano bajo anestesia general o regional, este estudio explora un enfoque ambulatorio con anestesia local, lo que podría ofrecer ventajas significativas en términos de comodidad para el paciente y reducción de costos6.
Método
Diseño del estudio
Estudio observacional retrospectivo que incluyó 52 pacientes con diagnóstico de VH refractaria al tratamiento conservador, tanto idiopática como neurogénica. Los pacientes fueron seleccionados de la consulta de urología de un hospital terciario, y los procedimientos se realizaron entre marzo de 2021 y enero de 2023. Los criterios de inclusión fueron:
- – Pacientes mayores de 18 años con diagnóstico confirmado de VH mediante estudios urodinámicos. Estos estudios se realizaron para garantizar un diagnóstico más preciso, evitar sesgos en la selección de participantes con otros diagnósticos que pueden generar síntomas similares y reducir posibles errores en la interpretación de los resultados, aunque posteriormente no se incluyeron como una variable de análisis en el estudio.
- – Falta de respuesta a anticolinérgicos o efectos adversos intolerables que impidieron su uso.
- – Pacientes con VH neurogénica secundaria a esclerosis múltiple, lesión medular o accidente cerebrovascular, y pacientes con VH idiopática.
- – Consentimiento informado firmado por los pacientes.
Se excluyeron los pacientes con infecciones urinarias activas, cálculos vesicales o contraindicaciones para el uso de BoNT-A incluidas en la ficha técnica del producto, como hipersensibilidad conocida a la toxina o a sus excipientes, infecciones activas en el sitio de inyección, trastornos neuromusculares graves como miastenia grave o síndrome de Lambert-Eaton, retención urinaria no tratada, embarazo y lactancia. Estas contraindicaciones fueron estrictamente consideradas para garantizar la seguridad de los pacientes incluidos en el estudio.
Procedimiento
El procedimiento se realizó en una sala de cistoscopias bajo anestesia local, utilizando en los hombres un cistoscopio flexible de 17 CH y en las mujeres un cistoscopio rígido de 20 CH. Antes de la intervención se obtuvo el consentimiento informado de todos los pacientes y se les entregó una hoja de indicaciones detallada. Los pacientes también completaron un diario miccional de 3 días antes del tratamiento, que se utilizó para evaluar su situación basal en cuanto a urgencia urinaria e incontinencia.
En términos de preparación, se administró profilaxis antibiótica oral. Las indicaciones incluyeron la suspensión de ciertos medicamentos potencialmente interactivos o que pudieran aumentar los riesgos durante el procedimiento. Se solicitaron las siguientes medidas:
- – Suspender los aminoglucósidos, las tetraciclinas, las lincosaminas y los relajantes musculares 4 semanas antes de la intervención.
- – Suspender los antiagregantes 5 días antes del procedimiento y reanudar su uso 24 horas después del mismo.
- – En los pacientes en tratamiento con anticoagulantes orales, sustituirlos por heparina de bajo peso molecular 5 días antes de la intervención y reanudarlos 24 horas después del procedimiento.
Una vez en la sala de cistoscopias, se inició el procedimiento con el vaciado de la vejiga mediante una sonda de 14 CH, seguido de la instilación de 40 ml de lidocaína al 5% durante 20 minutos. El paciente permaneció en decúbito supino durante los primeros 10 minutos y luego se colocó en decúbito lateral 5 minutos en cada lado para asegurar una distribución homogénea de la lidocaína y optimizar la anestesia vesical.
Posteriormente, se realizó el llenado de la vejiga con 100 ml de solución salina fisiológica, con el fin de evitar una distensión excesiva. La infiltración de BoNT-A se realizó con una aguja de 5 Fr/1,7 mm BONEE, inyectando 100 unidades de toxina en los pacientes con VH idiopática y 200 unidades en aquellos con VH neurogénica. Las inyecciones se distribuyeron en 10 puntos en el área retrotrigonal y en ambas caras laterales de la vejiga. La aguja penetró unos 2-4 mm en el detrusor, asegurando una distribución adecuada de la toxina. Cabe destacar que no se colocó sonda vesical tras el procedimiento, con el objetivo de evitar complicaciones y mejorar la comodidad del paciente.
El dolor se controló mediante una escala analógica visual (EVA), en la cual la mayoría de los pacientes reportaron valores < 2/10, lo que indica que el procedimiento fue bien tolerado en general. Tras finalizar la infiltración, los pacientes fueron monitorizados durante 30 minutos en la sala de recuperación para asegurar la ausencia de complicaciones inmediatas, tras lo cual fueron dados de alta el mismo día.
No se prescribieron antibióticos profilácticos sistemáticamente, salvo en aquellos pacientes en los que se identificó una infección urinaria durante la evaluación preoperatoria.
Instrucciones posprocedimiento
Una vez dados de alta, se proporcionaron instrucciones específicas para el manejo posprocedimiento. Los pacientes fueron instruidos para reincorporarse a su vida normal, con la recomendación de utilizar analgésicos simples si fuera necesario. Además, se les aconsejó beber abundante líquido y realizar micciones cada 2 horas, asegurándose de realizar una última micción antes de acostarse por la noche.
Se estableció un control telefónico por parte del equipo de enfermería a las 24 horas, con el fin de evaluar la presencia de síntomas como dolor, hematuria o dificultades para orinar. Se programó una consulta de revisión en 6 semanas, en la cual se reevaluaron los síntomas mediante un nuevo diario miccional de 3 días y el ICIQ-SF (International Consultation on Incontinence Questionnaire-Short Form) para la intensidad de los síntomas de incontinencia urinaria.
Evaluación de los resultados
Los resultados clínicos se evaluaron con los siguientes instrumentos:
- – ICIQ-SF: los pacientes lo completaron antes del tratamiento y en las visitas de seguimiento a 1, 6 y 9 meses. Este cuestionario mide la gravedad de los síntomas de incontinencia urinaria, con una puntuación que varía de 0 a 21, siendo las puntuaciones más altas indicativas de mayor gravedad. Se eligió el ICIQ-SF por estar validado en español5, lo que garantiza equivalencia cultural y lingüística, permitiendo obtener datos fiables en pacientes hispanohablantes. Además, su brevedad y su facilidad de administración lo hacen idóneo para estudios longitudinales, proporcionando una herramienta estandarizada para evaluar la gravedad de los síntomas y su impacto en la calidad de vida antes y después de las intervenciones terapéuticas5.
- – Satisfacción del paciente: a los 6 y 9 meses se evaluó la satisfacción global con el tratamiento mediante un cuestionario de satisfacción en el que los pacientes calificaban su experiencia como «muy satisfecho», «satisfecho», «insatisfecho» o «muy insatisfecho».
- – Complicaciones: se documentaron las complicaciones relacionadas con el procedimiento, como hematuria, infección urinaria o retención urinaria.
- – EVA: se utilizó para medir la percepción de dolor durante el procedimiento de infiltración de BoNT-A.
Estadística
El análisis estadístico de los datos se realizó utilizando el software SPSS versión 25.0. Las puntuaciones del ICIQ-SF antes y después del tratamiento se compararon mediante la prueba t de Student para muestras pareadas. Para evaluar la relación entre variables categóricas de interés, se utilizó un análisis de χ2. La variable dependiente fue la respuesta clínica, medida por la puntuación postratamiento del ICIQ-SF, categorizada en dos grupos: «satisfactoria» para puntuaciones ≤ 10 y «no satisfactoria» para puntuaciones > 10. Esta variable se comparó con los niveles de satisfacción reportados por los pacientes, clasificados en categorías según sus respuestas. Este análisis permitió determinar si existía una asociación significativa entre la mejora clínica objetiva y la percepción subjetiva de satisfacción tras el tratamiento. Para todas las pruebas estadísticas, se consideró un valor de p < 0,05 como indicativo de significación estadística.
Resultados
Eficacia del tratamiento con BoNT-A
De los 52 pacientes tratados con BoNT-A, 30 (57,7%) presentaron una respuesta clínica adecuada al mes de tratamiento, reduciendo significativamente el número de episodios de incontinencia y la urgencia urinaria. A los 6 meses, 25 pacientes (48,1%) mantuvieron la mejoría, y a los 9 meses 22 pacientes (42,3%) continuaron experimentando beneficios clínicos (Fig. 1).
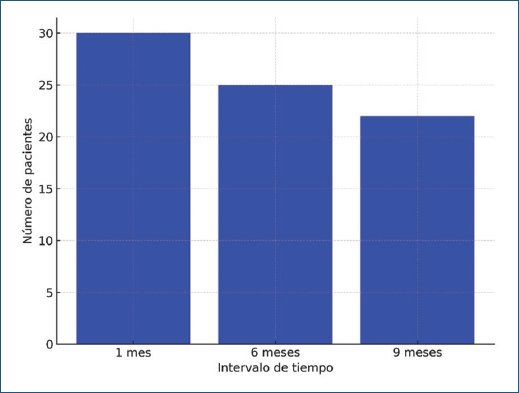
Figura 1. Respuesta clínica a la toxina botulínica tipo A a lo largo del tiempo.
Resultados del ICIQ-SF
La puntuación promedio del ICIQ-SF antes del tratamiento fue de 18 puntos y tras la aplicación de la BoNT-A se redujo significativamente a 7,25 puntos (p < 0,001). Este resultado refleja una mejoría notable en los síntomas de incontinencia urinaria en la mayoría de los pacientes (Tabla 1).
Tabla 1. Puntuación ICIQ-SF previa y posterior al tratamiento con toxina botulínica tipo A
| Puntuación ICIQ-SF previa | N.º pacientes pretoxina | Puntuación ICIQ-SF posterior | N.º pacientes postoxina |
|---|---|---|---|
| 21 | 9 | 2 | 14 |
| 20 | 5 | 5 | 8 |
| 19 | 5 | 8 | 1 |
| 18 | 5 | 15 | 2 |
| 17 | 10 | 18 | 3 |
| 16 | 5 | 20 | 2 |
| 15 | 5 | 21 | 3 |
| 14 | 4 | 3 | 1 |
| 13 | 4 | 4 | 6 |
La prueba t de Student para muestras pareadas mostró un valor de 9,83 y una p = 0.00000000000421, lo que indica una diferencia estadísticamente significativa entre las puntuaciones de incontinencia antes y después del tratamiento con BoNT-A (Tabla 1 y Fig. 2).
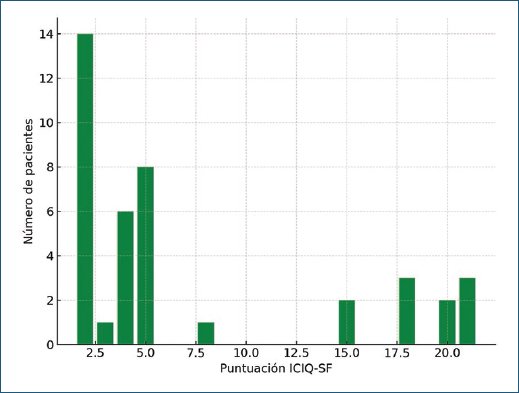
Figura 2. Distribución de la puntuación en el ICIQ-SF después del tratamiento con toxina botulínica tipo A.
Satisfacción del paciente
En cuanto a la satisfacción global, a los 6 meses el 85% de los pacientes informaron estar satisfechos o muy satisfechos con el tratamiento. Esta tendencia se mantuvo estable en el seguimiento a 9 meses, con un 60% de los pacientes aún satisfechos con los resultados. Los pacientes que no mostraron una mejoría clínica significativa en los síntomas de incontinencia reportaron una satisfacción más baja, lo que sugiere una fuerte correlación entre la efectividad clínica de la toxina y la satisfacción del paciente. Solo el 15% de los pacientes se mostraron insatisfechos con el tratamiento debido a la persistencia de los síntomas, mientras que un 5% refirieron efectos adversos, como hematuria.
Resultados de la EVA
Durante el procedimiento, el 90% de los pacientes reportaron una EVA < 2, lo que indica que la inyección de BoNT-A fue bien tolerada bajo anestesia local. El 10% restante calificaron el dolor entre 2 y 4 en la escala, y ningún paciente experimentó dolor intenso (> 4). En el seguimiento a las 24 horas del procedimiento, el dolor reportado disminuyó aún más, con una media de 1 en la EVA, lo que sugiere una rápida recuperación tras la infiltración sin necesidad de analgesia adicional para la mayoría de los pacientes. Estos resultados confirman que el procedimiento es generalmente bien tolerado, con niveles de dolor mínimos tanto durante como después de la intervención, lo que demuestra la viabilidad de realizar la infiltración de BoNT-A en un entorno ambulatorio con anestesia local.
Complicaciones
La complicación más frecuente observada fue la hematuria autolimitada, reportada por 18 pacientes (34,6%); en todos los casos fue leve y se resolvió sin necesidad de intervención médica adicional. Tres pacientes (5,8%) desarrollaron infecciones del tracto urinario en las primeras 2 semanas postratamiento, las cuales fueron tratadas con antibióticos orales sin complicaciones adicionales. No se documentaron casos de retención urinaria, lo que resalta la seguridad del procedimiento cuando se realiza en un entorno ambulatorio6.
Análisis bivariado de variables categóricas de interés: relación entre la respuesta clínica y la satisfacción del paciente
Los resultados del análisis mostraron un estadístico χ2 de 11.56 con p = 0.073 y 6 grados de libertad. Aunque no se alcanzó la significación estadística (p > 0.05), la tendencia observada sugiere una posible correlación entre la efectividad del tratamiento y la satisfacción del paciente (Tabla 2).
Tabla 2. Relación entre la respuesta clínica y la satisfacción del paciente
| Respuesta clínica | Satisfacción | N.º pacientes |
|---|---|---|
| Adecuada | Muy satisfecho | 30 |
| Adecuada | Satisfecho | 15 |
| Inadecuada | Insatisfecho | 7 |
El valor p cercano a 0.05 sugiere que, aunque no se alcanzó la significación estadística, existe una tendencia que podría indicar que los pacientes que experimentaron una mejor respuesta clínica (puntuación tras la toxina < 10) también reportaron niveles más altos de satisfacción. Esto es concordante con estudios previos que demostraron que la efectividad clínica de la BoNT-A influye directamente en la percepción de éxito del tratamiento por parte de los pacientes7,8.
Discusión
Este estudio reafirma el valor de la BoNT-A como una opción terapéutica efectiva para pacientes con VH refractaria, especialmente en aquellos que no han respondido a tratamientos conservadores9,10. Los resultados obtenidos son concordantes con los de investigaciones previas que demostraron la capacidad de la BoNT-A para reducir la incontinencia urinaria, la urgencia y la frecuencia miccional en los pacientes con VH7,8. La efectividad observada en nuestro estudio, con un 57,7% de los pacientes reportando mejoría clínica a los 30 días postratamiento, coincide con estudios previos que informan tasas de éxito del 50% al 70%11,12.
Uno de los aspectos más relevantes de este estudio es que se realizó bajo un protocolo ambulatorio con anestesia local, lo cual representa una ventaja significativa en términos de comodidad para el paciente y de reducción de los costos hospitalarios. Tradicionalmente, la administración de BoNT-A se ha realizado en quirófano bajo anestesia regional o general, lo que aumenta los riesgos y el tiempo de recuperación. En nuestro estudio, todos los pacientes fueron dados de alta el mismo día sin necesidad de hospitalización, y el procedimiento fue bien tolerado por la mayoría de ellos, con complicaciones mínimas y autolimitadas.
Respuesta clínica según la etiología
La respuesta al tratamiento fue ligeramente superior en los pacientes con VH idiopática en comparación con aquellos con VH neurogénica, lo cual está en línea con los estudios que sugieren que la etiología de la VH puede influir en la respuesta a la BoNT-A13. Sin embargo, aunque la respuesta fue menor en los pacientes con VH neurogénica, la mayoría de estos pacientes también experimentaron una mejoría de los síntomas, lo que sugiere que la BoNT-A sigue siendo una opción terapéutica válida en este subgrupo.
Limitaciones del estudio
Una de las principales limitaciones del estudio es su naturaleza retrospectiva, lo que puede introducir sesgos en la selección de los pacientes. Además, el tamaño de la muestra fue relativamente pequeño y el seguimiento se limitó a 9 meses. Futuros estudios prospectivos con un mayor número de pacientes y un seguimiento más prolongado permitirán confirmar estos resultados y evaluar la durabilidad de los efectos de la BoNT-A a largo plazo.
Otra limitación es la falta de un grupo control comparativo que recibiera placebo o tratamiento estándar, lo que hubiera permitido una comparación más robusta de la efectividad de la BoNT-A frente a otras intervenciones. Sin embargo, la mejoría observada en los pacientes, respaldada por las reducciones en la puntuación del ICIQ-SF, proporciona evidencia de la eficacia del tratamiento en un entorno ambulatorio.
Implicaciones clínicas
Los resultados de este estudio tienen implicaciones clínicas importantes, ya que indican que la administración de BoNT-A en un entorno ambulatorio es una opción viable y segura para pacientes con VH refractaria. Este enfoque ofrece una alternativa menos invasiva que la cirugía, con una tasa de complicaciones baja y unos niveles altos de satisfacción de los pacientes. Además, el uso de anestesia local reduce los riesgos asociados con la anestesia general o regional, haciendo más accesible el procedimiento para pacientes con comorbilidad o con contraindicaciones para intervenciones quirúrgicas más invasivas.
Conclusiones
La infiltración de BoNT-A en un entorno ambulatorio bajo anestesia local es una opción terapéutica segura y eficaz para pacientes con VH refractaria. Los resultados de este estudio muestran una mejoría significativa en los síntomas de incontinencia urinaria y unos altos niveles de satisfacción de los pacientes, con una baja incidencia de complicaciones. Este enfoque tiene el potencial de convertirse en una opción estándar para el tratamiento de la VH, ofreciendo a los pacientes una solución menos invasiva y más accesible. Se requieren estudios adicionales para confirmar estos hallazgos y evaluar la durabilidad del tratamiento a largo plazo.
Financiamiento
Los autores declaran que este trabajo se realizó con recursos propios.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki. Los procedimientos fueron autorizados por el Comité de Ética de la institución.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
