Introducción
El cáncer de próstata es el segundo cáncer más diagnosticado en los hombres en todo el mundo y corresponde a la quinta causa de mortalidad por cáncer1. La terapia de privación androgénica constituye el estándar de manejo en el cáncer de próstata metastásico, siendo el antígeno prostático específico (PSA) el biomarcador de elección para evaluar la progresión de la enfermedad y la respuesta al tratamiento2. La literatura reporta que los niveles de PSA más bajos se asocian con una disminución de la mortalidad2. La duración de la respuesta a la terapia de privación androgénica y la supervivencia son variables en los subgrupos de pacientes2. Pese a que el nadir del PSA postratamiento en pacientes con cáncer de próstata sensible a hormonas metastásico (CPHSm) ha demostrado correlación con los desenlaces clínicos3, a la fecha no existen variables claras que identifiquen a los pacientes con peor pronóstico con un alto nivel de evidencia, ni existe un subrogado validado para la supervivencia en cáncer de próstata metastásico4. La posibilidad de evaluar el pronóstico de manera individual mejoraría el diseño de los estudios y el desarrollo de ensayos clínicos completos, maximizando el beneficio clínico a la vez que se reduce la exposición tóxica innecesaria.
En nuestro medio es limitada la literatura que describe los factores pronóstico asociados a la supervivencia de los pacientes con cáncer de próstata metastásico. Por lo tanto, este trabajo tiene como objetivo evaluar la relación entre el nadir del PSA como predictor de la supervivencia global (SG) de los pacientes con CPHSm que fueron tratados con orquiectomía bilateral simple en un centro de referencia en Colombia, así como identificar factores pronóstico adicionales asociados a la SG y factores predictores asociados a la supervivencia libre de progresión (SLP) (resistencia a la castración).
Método
Estudio de cohorte retrospectivo, desarrollado en un centro de referencia de cuarto nivel en Colombia. Los datos demográficos y clínico-patológicos se obtuvieron de los registros clínicos hospitalarios de pacientes mayores de 18 años con diagnóstico de cáncer de próstata confirmado por patología (biopsia de próstata) o con diagnóstico clínico, tratados con orquiectomía bilateral simple entre 2009 y 2022. Se incluyeron los pacientes con cualquier estadio c/pT, cualquier c/pN, con estadio cM1b sensibles a la castración, y pacientes que hubieran recibido tratamiento con intención curativa previamente. Se excluyeron los pacientes con administración de terapia de privación androgénica farmacológica previa a la orquiectomía, con datos clínicos de interés incompletos en los registros clínicos o sin seguimiento por más de 6 meses, con excepción de aquellos con menor tiempo a causa de muerte. El estudio fue aprobado por el Comité de Investigación Ética de la institución.
Se realizó un análisis descriptivo de los datos con medias, desviación estándar, medianas y porcentajes. Las variables continúas se compararon utilizando la prueba t de Student y las variables categóricas mediante el test de χ2. Se realizaron análisis uni- y multivariado, con curvas de Kaplan-Meier para valorar los factores predictores de SG, y la relación entre el nadir del PSA, el porcentaje de reducción del PSA y el tiempo hasta el nadir con la SLP. Se realizó un análisis por subgrupos entre el nadir del PSA < 0,2 y ≥ 0,2 ng/ml, el porcentaje de reducción del PSA < 50%, 50-90% y ≥ 90%, y el tiempo hasta el nadir del PSA ≤ 6 y > 6 meses. Los datos se procesaron en STATA 13.0. Se consideró un valor p < 0,05 como estadísticamente significativo.
Resultados
En el análisis final se incluyeron 220 pacientes, con una mediana de edad de 69.9 años (rango: 42-92) y una mediana de tiempo de seguimiento de 24 meses. En cuanto a la clasificación funcional de los pacientes (ECOG, Eastern Cooperative Oncology Group), 103 (46,8%) fueron ECOG 1 y 87 (39,6%) fueron ECOG 0. Adicionalmente, 148 pacientes (67,3%) tenían estadio T3-T4 de la enfermedad y 134 (60,9%) estadio ganglionar N1. Tuvieron diagnóstico sincrónico de la enfermedad 185 pacientes (84,1%), siendo esta de alto volumen en 165 (75%). Recibieron intensificación de la terapia 61 pacientes (27,8%), principalmente con docetaxel el 20,5%, seguido de la combinación de docetaxel con abiraterona en el 3,6%. La mediana del nadir del PSA fue de 0,96 ng/ml, con una reducción del 99,2% y una mediana de tiempo hasta el nadir de 13 meses. Presentaron resistencia a la castración 99 pacientes (45%). En la tabla 1 se resumen las características clínicas de los pacientes estudiados.
Tabla 1. Características demográficas y clínico-patológicas de los pacientes
| Número de pacientes | 220 |
| Edad al diagnóstico de CPHSm, años (rango) | 69,9 (42-92) |
| Tiempo de seguimiento, meses (rango) | 24 (1-142) |
| ECOG, n (%) | |
| 0 | 87 (39,6) |
| 1 | 103 (46,8) |
| 2 | 22 (10) |
| 3 | 8 (3,6) |
| Estadio c/pT, n (%) | |
| T1-2 | 55 (25) |
| T3-4 | 148 (67,3) |
| Tx | 17 (7,7) |
| Estadio c/pN, n (%) | |
| N0 | 19 (8,6) |
| N1 | 134 (60,9) |
| Nx | 67 (30,5) |
| PSA inicial, ng/ml (rango) | 100 (2,89-11814) |
| Diagnóstico, n (%) | |
| Sincrónico | 185 (84,1) |
| Metacrónico | 35 (15,9) |
| Volumen de enfermedad*, n (%) | |
| Alto | 165 (75) |
| Bajo | 55 (25) |
| Terapia de intensificación en CPHSm, n (%) | 61 (27,8) |
| Docetaxel | 45 (20,5) |
| Docetaxel+abiraterona | 8 (3,6) |
| Abiraterona | 5 (2,3) |
| Enzalutamida | 2 (0,5) |
| Apalutamida | 1 (0,9) |
| PSA previo al tratamiento, ng/ml (rango) | 118,7 (1,54-11.264) |
| Nadir de PSA, ng/ml (rango) | 0,96 (0-418,4) |
| < 0,2 ng/ml | 73 (33,2) |
| ≥ 0,2 ng/ml | 147 (66,8) |
| Tiempo hasta el nadir de PSA, meses (rango) | 13 (1-140) |
| ≤ 6 meses | 37 (16,8) |
| > 6 meses | 183 (83,2) |
| Reducción del PSA, % (rango) | 99,2 (22,35-100) |
| < 50% | 7 (3,2) |
| 50-90% | 23 (10,4) |
| ≥ 90% | 190 (86,4) |
| Resistencia a la castración, n (%) | 99 (45) |
|
CPHSm: cáncer de próstata sensible a hormonas metastásico; ECOG: Eastern Cooperative Oncology Group; PSA: antígeno prostático específico. * CHAARTED. |
|
La mediana de la SLP fue de 34 meses (intervalo de confianza del 95% [IC 95%]: 29-68), con una disminución de 4 meses en los pacientes sin intensificación (30 meses; IC 95%: 20-68) (Fig. 1). La mediana de la SG fue de 43,9 meses (IC 95%: 37,03-49,13), que se mantuvo en el grupo sin terapia de intensificación (44,5 meses; IC 95%: 37,36-52,66) (Fig. 2).
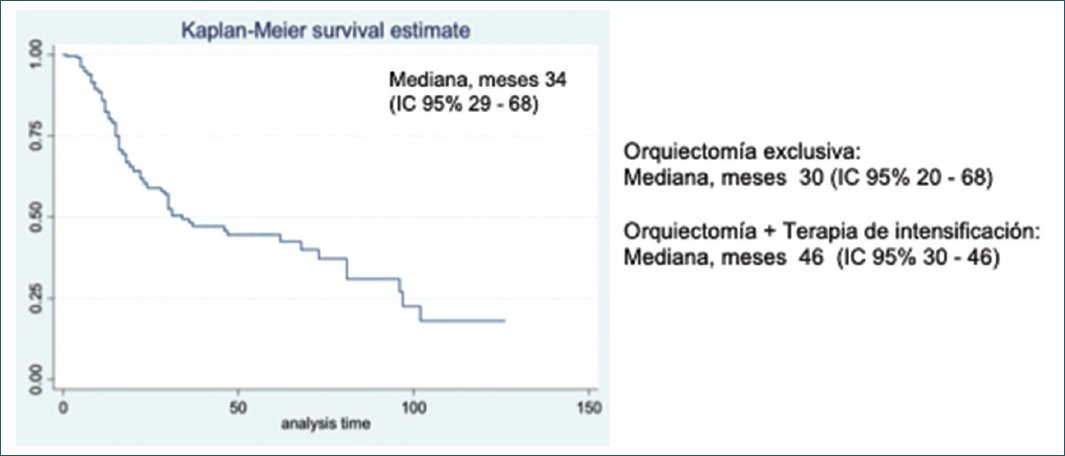
Figura 1. Curva de Kaplan-Meier de la supervivencia libre de progresión.
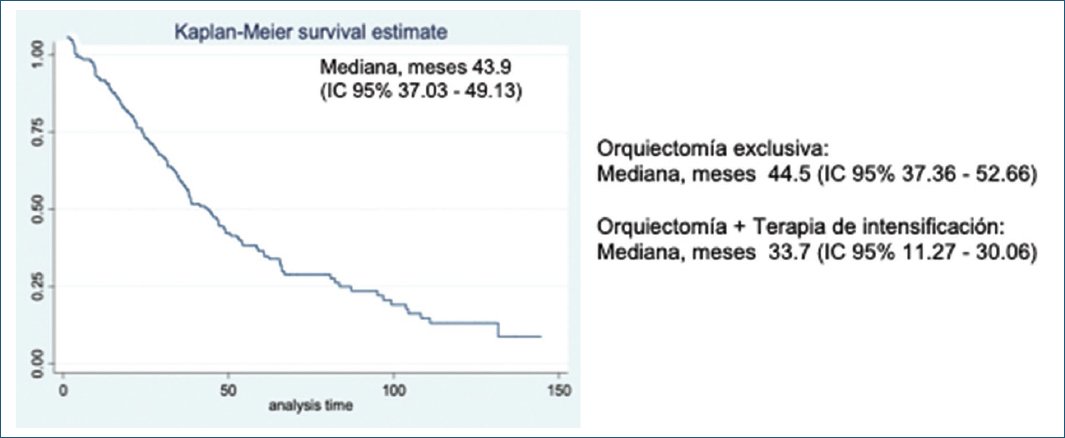
Figura 2. Curva de Kaplan-Meier de la supervivencia global.
En el análisis multivariado se identificaron como factores predictores de SLP el nadir de PSA ≥ 0,2 ng/ml (hazard ratio [HR]: 6,28; IC 95%: 3,46-11,37; p < 0,001), la reducción del PSA ≥ 90% (HR: 0,23; IC 95%: 0,095-0,59; p = 0,002) y el tiempo hasta el nadir del PSA > 6 meses (HR: 0,34; IC 95%: 0,21-0,55; p < 0,001) (Fig. 3). Los factores predictores de SG identificados fueron el nadir de PSA ≥ 0,2 ng/ml (HR: 2,59; IC 95%: 1,70-3,96; p < 0,001) y el tiempo hasta el nadir de PSA > 6 meses (HR: 0,37; IC 95%: 0,24-0,56; p < 0,001) (Fig. 4). La edad en el momento del diagnóstico del CPHSm, el estadio ganglionar, el volumen de la enfermedad y el PSA inicial o previo a la orquiectomía no se identificaron como factores predictores de SG ni de SLP. En las tablas 2 y 3 se resume el análisis de regresión de Cox simple de los factores predictores de SLP y de SG.
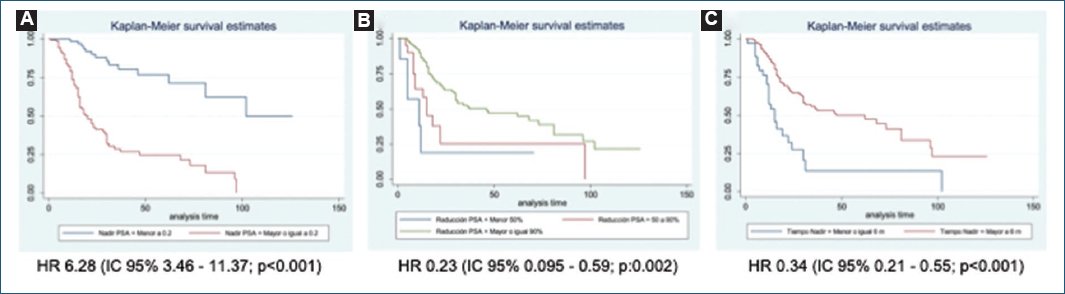
Figura 3. Curvas de Kaplan-Meier de la supervivencia libre de progresión en el análisis por subgrupos: nadir de antígeno prostático específico (PSA) (A), porcentaje de reducción del PSA (B) y tiempo hasta el nadir de PSA (C).
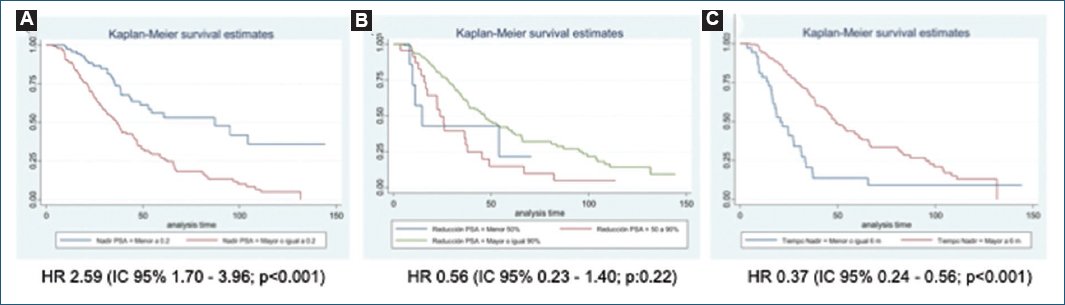
Figura 4. Curvas de Kaplan-Meier de la supervivencia global en el análisis por subgrupos: nadir de antígeno prostático específico (PSA) (A), porcentaje de reducción del PSA (B) y tiempo hasta el nadir de PSA (C).
Tabla 2. Análisis de regresión Cox simple de los factores predictores de supervivencia libre de progresión
| Variable | HR | IC 95% | p |
|---|---|---|---|
| Edad al diagnóstico de CPHSm | 0,99 | 0,97-1,01 | 0,84 |
| c/pNN0N1 | 2,08 | 0,84-5,15 | 0,11 |
| DiagnósticoSincrónicoMetacrónico | 0,94 | 0,54-1,65 | 0,84 |
| Volumen de enfermedad AltoBajo | 1,23 | 0,75-1,99 | 0,40 |
| PSA inicial | 0,99 | 0,98-1,01 | 0,61 |
| PSA previo al tratamiento | 0,99 | 0,98-1,01 | 0,64 |
| Nadir de PSA< 0,2 ng/ml≥ 0,2 ng/ml | 1,003Ref.6,28 | 1,0-1,007Ref.3,46-11,37 | 0,021–< 0,001 |
| Reducción del PSA < 50% 50-90% ≥ 90% | 0,092Ref.0,620,23 | 0,03-0,26Ref.0,22-1,780,095-0,59 | < 0,001–0,380,002 | Tiempo hasta nadir de PSA ≤ 6 meses > 6 meses | 0,96Ref.0,34 | 0,94-0,98Ref.0,21-0,55 | < 0,001–< 0,001 |
|
CPHSm: cáncer de próstata sensible a hormonas metastásico; HR: hazard ratio; IC 95%: intervalo de confianza del 95%; PSA: antígeno prostático específico. |
|||
Tabla 3. Análisis de regresión Cox simple de los factores predictores de supervivencia global
| Variable | HR | IC 95% | p |
|---|---|---|---|
| Edad al diagnóstico de CPHSm | 1,0 | 0,98-1,02 | 0,64 |
| c/pN N0 N1 | 2,18 | 0,88-5,41 | 0,09 |
| Diagnóstico Sincrónico Metacrónico | 0,81 | 0,49-1,36 | 0,44 |
| Volumen de enfermedad Alto Bajo | 1,34 | 0,88-2,03 | 0,16 |
| PSA inicial | 0,99 | 0,98-1,01 | 0,92 |
| PSA previo al tratamiento | 1,0 | 0,99-1,01 | 0,96 |
| Nadir de PSA < 0,2 ng/ml ≥ 0,2 ng/ml | 1,006Ref.2,59 | 1,003-1,008Ref. | < 0,001–< 0,001 |
| Reducción del PSA < 50% 50-90% ≥ 90% | 0,27Ref.1,220,56 | 0,10-0,77Ref.0,45-3,270,23-1,40 | 0,014– 0,680,22 |
|
CPHSm: cáncer de próstata sensible a hormonas metastásico; HR: hazard ratio; IC 95%: intervalo de confianza del 95%; PSA: antígeno prostático específico. |
|||
Discusión
El PSA proporciona información útil para monitorear el tratamiento y la progresión de la enfermedad2. Las concentraciones de PSA disminuyen un 80% en aproximadamente el 80% de los pacientes en el primer mes después de la terapia de privación androgénica5, y se normalizan en el 95% de los casos en 3 a 6 meses6. El aumento del PSA después del valor bajo de nadir representa el primer signo objetivo de resistencia a la castración. La mayoría de los pacientes de nuestra serie respondieron a la orquiectomía; el 33,2% alcanzaron un nadir de PSA < 0,2 ng/ml. El 45% de los pacientes presentaron progresión de la enfermedad, con una mediana de 34 meses.
La terapia de privación androgénica ha sido ampliamente aceptada en el tratamiento del cáncer de próstata avanzado2. Es importante investigar los factores predictores de supervivencia con el fin de identificar aquellos pacientes con enfermedad de alto riesgo, en quienes puedan considerarse otras formas de terapia sistémica desde el principio.
Como la evidencia en nuestro medio sobre el rol del nadir de PSA en los pacientes con cáncer de próstata metastásico después de la orquiectomía simple es limitada, llevamos a cabo este estudio para valorar la importancia pronóstica del nadir de PSA en este grupo de pacientes. Varios estudios han evaluado el nadir de PSA como factor pronóstico. Kwak et al.7 publicaron en 2002 un estudio retrospectivo en el que estudiaron la SG y la progresión a resistencia a la castración según el nadir de PSA en pacientes con cáncer de próstata metastásico. Incluyeron 177 pacientes, con una mediana de seguimiento de 39 meses, y reportaron un tiempo hasta el nadir de PSA de 8,1 meses y una mediana de SLP de 24 meses. El análisis univariado identificó como factores asociados a la SLP el valor inicial del PSA, las metástasis óseas, el PSA a los 6 meses y el nadir del PSA (p < 0,001); sin embargo, el análisis por subgrupos únicamente identificó el nadir del PSA entre 1,1 y 10 ng/ml (HR: 4,13; IC 95%: 1,85-9,24) o ≥ 10,1 ng/ml (HR: 4,24; IC 95%: 1,90-14,16). Como factores asociados a la SG encontraron el valor inicial del PSA, la puntuación de Gleason, las metástasis óseas y el nadir del PSA (p < 0,001); de igual forma, el análisis por subgrupos únicamente identificó el nadir del PSA entre 0,2 y 1 ng/ml (HR: 2,02; IC 95%: 1,18-7,33), entre 1,1 y 10 ng/ml (HR: 3,68; IC 95%: 1,62-14,51) o ≥ 10,1 ng/ml (HR: 4,85; IC 95%: 1,88-21,63)7.
Más adelante, Choueiri et al.8 realizaron un estudio retrospectivo con 179 pacientes con CPHSm tratados con terapia de privación androgénica, con una mediana de seguimiento de 4 años y una mediana de 6 meses de tiempo hasta alcanzar el nadir de PSA. El análisis multivariado reportó como factores predictores de SG el nadir del PSA ≥ 0,2 ng/ml (HR: 3,85; p < 0,001), el tiempo hasta el nadir de PSA < 6 meses (HR: 0,48; p = 0,005) y la puntuación de Gleason > 7.
Tomioka et al.3 publicaron en 2014 un estudio retrospectivo de 286 pacientes, con una mediana de seguimiento de 4 años. Reportan una mediana de tiempo hasta el nadir de 9,4 meses, y de 13 meses para la resistencia a la castración, además de una mediana de SG de 113 meses. Identificaron como factores pronóstico de SLP la puntuación de Gleason, el nadir de PSA entre 0,2 y 4 ng/ml o ≥ 4 ng/ml, y el tiempo hasta el nadir de PSA < 12 meses. Como factores asociados a la SG encontraron el nadir de PSA entre 0,2 y 4 ng/ml (HR: 2,32; p < 0,001) o ≥ 4 ng/ml (HR: 5,22; p < 0,001), y el tiempo hasta el nadir de PSA < 6 meses (HR: 4,0; p < 0,001).
Por último, en un ensayo aleatorizado de fase 3 se halló un nivel de PSA ≤ 4 ng/ml después de 7 meses de terapia de privación androgénica primaria como fuerte predictor independiente de la mejora en la supervivencia en el CPHSm4.
El punto de corte óptimo del nadir de PSA y el tiempo hasta alcanzarlo predicen una respuesta corta o larga a la terapia de privación androgénica primaria. En nuestro estudio, el nadir del PSA y el tiempo en lograrlo son factores importantes asociados tanto a la SG como al cáncer de próstata resistente a la castración. Un nadir de PSA ≥ 0.2 ng/ml se asoció de forma independiente con una SG más corta, y el tiempo hasta el nadir de PSA > 6 meses como factor protector se asoció con una disminución del 63% del riesgo de muerte; así, una respuesta rápida del nadir se traduce en una enfermedad de mayor agresividad. Los mecanismos implicados en la asociación de un tiempo más corto hasta el nadir y un peor pronóstico no están claros. Esto puede explicarse por una selección de un subconjunto de células agresivas que rápidamente adquieren resistencia a la castración o que no dependían tanto del receptor de andrógenos para su viabilidad7. Una rápida disminución en el nivel de PSA puede estar relacionada con un efecto transcripcional de la terapia de privación androgénica en la progresión del PSA, en lugar de con la muerte celular del cáncer de próstata9. Otra posibilidad es que la inhibición de la función del receptor de andrógenos y la supresión rápida de los andrógenos (receptor) durante la terapia de privación androgénica tengan un efecto negativo, a causa de que el receptor de andrógenos actúe como un agente supresor de tumores10.
Dentro de las fortalezas de nuestro estudio cabe mencionar la inclusión de datos de una población local de un centro de referencia oncológico. Así mismo, presenta algunas limitaciones, como el tipo y el diseño del estudio (retrospectivo), realizado en un único centro, con seguimiento no estandarizado y escaso número de pacientes con terapia de intensificación, lo que no permite la realización de un análisis comparativo, por lo cual son necesarios más estudios prospectivos.
Conclusiones
El nadir del PSA es un predictor de SG de los pacientes con CPHSm. La mediana de SG fue de 43,9 meses y se mantuvo en el grupo sin terapia de intensificación. Los factores predictores de SG identificados fueron el nadir del PSA ≥ 0,2 ng/ml y el tiempo hasta nadir de PSA > 6 meses, en concordancia con la literatura revisada. Los factores predictores de SLP identificados fueron el nadir del PSA ≥ 0,2 ng/ml, la reducción del PSA ≥ 90% y el tiempo hasta el nadir de PSA > 6 meses. La orquiectomía simple bilateral hace parte del estándar de manejo del cáncer de próstata metastásico.
Financiamiento
Los autores declaran que este trabajo se realizó con recursos propios.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki. Los procedimientos fueron autorizados por el Comité de Ética de la institución.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han obtenido la aprobación del Comité de Ética para el análisis de datos clínicos obtenidos de forma rutinaria y anonimizados, por lo que no fue necesario el consentimiento informado. Se han seguido las recomendaciones pertinentes.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
